从晶体结构来解读PA tag系统的原理及其在蛋白质环区的插入

大阪大学 蛋白质研究所 松永幸子、有森贵夫、高木淳一
1、前言
进行蛋白质的结构分析和功能分析需要提取高纯度的蛋白。为了更有效地进行样本制备,本研究室开发了亲和标记系统。1,2)其中,由12个氨基酸残基组成的PA tag(GVAMPGAEDDVV)以极高的亲和性与其单克隆抗体NZ-1特异性结合(KD = 4×10 -10 M),并且可以很容易地与PA肽竞争性洗脱,所以PA tag系统可以一步提取高纯度以及高回收量的目标蛋白3,4)。起初,日本东北大学的加藤幸成教授等人发现了在恶性肿瘤细胞中显著表达的膜蛋白podoplanin的部分序列(即PA tag序列)的特异性抗体NZ-15),以此作为PA tag系统的开发基础。作者们把注意力集中在NZ-1与单一PA肽的强结合特点上,建立了一套亲和标记系统。详细情况请参考《和光纯药时报Vol.82,No.4(2014)》以及文献4。最近,作者们确定了PA肽和NZ-1复合物的晶体结构,并从其特有的复合物形成机制中开发了PA tag系统的新用途6)。在本文中,我们将阐述PA tag系统在PA tag环形构造中插入及其作为蛋白功能分析工具的应用实例。
2、PA tag肽-NZ-1抗体复合体的结构分析
如开头所述,PA tag以高亲和性与NZ-1结合。为了了解其机理,本研究室确定了NZ-1的Fab片段及其与PA肽的复合体晶体结构(PDB ID:4YNY,4YO0)。如图1a所示,PA肽以Met4-Asp10为中心,整体与NZ-1抗体接触,并紧密地嵌合在抗原识别位点的结合口袋中。另外,Pro5-Gly 6序列的部分具有β-转角结构。Pro-Gly序列在溶液中可以简单形成II型的β-转角结构7),因此可以预测,PA肽在与NZ-1结合之前就可以形成最适结合结构。抗体的特征也与PA肽特征类似,在肽结合前后几乎观察不到立体结构以及水合状态的变化。也就是说,晶体结构表明在PA tag系统中随着肽和抗体二者同时结合的熵损失非常小。相互作用的亲和性由结合前后的能量差决定,因此认为熵损失量小是PA tag系统具有高亲和性的主要原因。
此外,一个非常有趣的发现是,NZ-1识别出具有U形弯曲结构的PA tag。一般而言,肽不会在溶液中呈现特定结构,即使它们与抗体结合,它们更多地采用相对伸长结构(图1b)。也就是说,除非处于松散状态,否则抗体就难以识别它,现有的多肽标签多数情况下仅仅可以添加到蛋白的柔性区域,即N末端或C末端。在PA tag中,由于NZ-1识别PA肽的折叠结构,所以PA太的N末端和C末端在被抗体识别的状态下方向相同,距离也更接近(图1b)。从此特征出来看,期待着PA tag不仅能在蛋白末端起作用,而且在插入环区的U形转角也能起到标签作用,而被NZ-1识别。
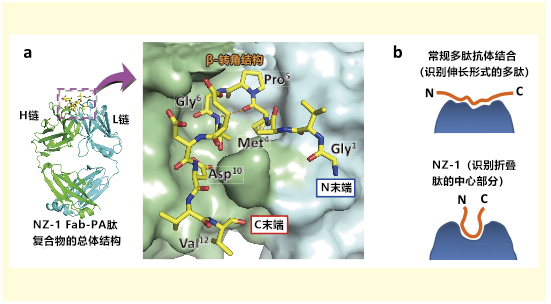
图1. NZ-1的PA肽识别机制
(a)NZ-1-PA肽复合体的总体结构和抗原结合位点的放大图。 PA肽(黄色条形模型)呈U形结构,N末端与C末端之间
的距离接近。
(b)抗多肽抗体的肽识别模式。
3、插入至PA tag环区
选择血小板膜蛋白中的整合素作为插入PA tag序列环区中的测试样本。整合素是α链和β链的异源二聚体,由αⅡb链和β3链组成的整合素αⅡbβ3立体构造和功能分析的相关报道较多,而且仅在细胞外域作为可溶性蛋白显著表达,因此可作为评估PA tag插入效果的最适分子8)。首先,选择暴露在αⅡb链的分子表面上的8个环区(尤其是转角结构),制备插入PA序列的12个残基的突变体(图2a和2b)。接下来,当这些插入PA tag的αⅡb链突变体与β3链一起作为可溶性蛋白表达时,通过NZ-1抗体和抗β3链抗体进行免疫沉淀,PA tag保留着其亲和标记的功能,同时也不会对β3链的异源二聚体的形成产生不利影响(图2c)。使用FLAG标签和Myc标签也进行同样的实验,但完全不被识别(分别针对抗FLAG标签的M2抗体和抗Myc标签的9E10抗体),因此插入环区的功能可以说是PA tag所特有的6)。
这种可插入性质究竟在什么情况下起作用呢?实际上这种性质可以应用到多个方面:一种情况就是无法将标签添加到目标分子末端时。如果蛋白的N-末端或C-末端残基正是其功能区,那么与活性部位相邻的位置无法添加标签。以神经轴突导向因子semaphorin 3A为例,Semaphorin 3A两端都存在活性位点并且具有多个与受体结合的位点,是适用于选择插入"不影响功能的环区"的分子。事实上,作者们通过将PA tag插入semaphorin 3A的环区,成功地制备了高活性样本6)。到目前为止已经探讨过在20种以上的蛋白环区中插入PA tag,若实验设计顺利的话,就可以比较自由地将PA tag结合到蛋白环区中。
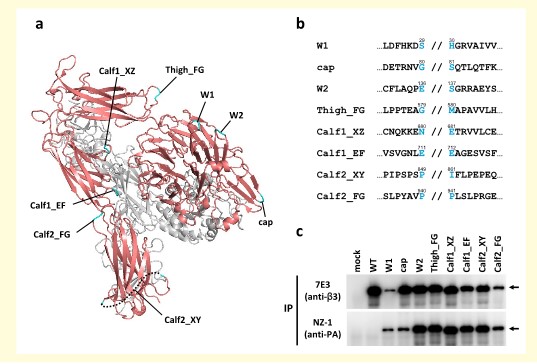
图2. PA tag在整合素环区的插入
(a)整合素αⅡb(红色)β3(灰色)细胞外域的三维结构(PDB ID:3 FCS)。青绿色表示插入环区的PA tag。
(b)插入位点附近的氨基酸序列。 将12残基PA tag插入//的位置。
(c)各种PA tag插入突变体经过抗整联蛋白抗体(7E3,上排)和抗PA tag抗体(NZ-1,下排)的免疫沉淀的结果。
根据文献6改编转载。
4、插入PA tag作为报告分子的应用
插入环中的PA tag除了可作为纯化标签,还可用于分子的功能分析。选择整联蛋白αⅡb链作为目标分子除了上述原因之外还有一个重要原因。整合素的分子活性受其结构变化的影响9),其结构在非活性状态(弓形结构)和活性状态(直立结构)中发生显著变化。因此,在这种结构变化前后,如果在暴露发生变化的位置插入PA tag,就可以通过NZ-1的结合量的变化来监测整合素的结构变化(图3a)。为此,我们识别了图2中插入PA tag的αⅡb链在细胞膜上的三种突变体(W2,Thigh_FG,Calf1_EF),并通过流式细胞术分析。其中,即使是在非活性状态下,在分子外部标记PA tag的W2和Thigh_FG中,无论整合素的活性状态如何,都能以相同的效率结合NZ-1(图3b,W2和Thigh_FG, 蓝色和红色直方图)。与之相对的,当PA tag位于弓形结构内部的Calf 1_EF时,未激活状态下与其他部分相比,NZ-1较难识别(图3b,Calf 1 _EF,蓝色直方图),估计是几乎不在分子表面暴露。然而,一旦提高整联素活性(图3b,小牛1 _EF,红色直方图),NZ-1的反应性会增加(直方图峰向右移动)。通过这种方式,仅利用12个残基PA肽的插入就可以追踪整合素的结构变化。
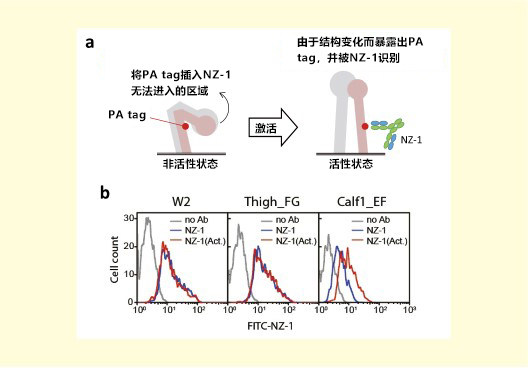
图3. 整联素作为靶分子,PA tag环区插入法的应用实例
(a)使用PA tag系统监测整合素的结构变化。
(b)三种整联蛋白αⅡb链PA tag插入突变体的非活性状态(蓝色)和活性(红色)状态的流式细胞术直方图。根据文
献6改编转载。
5、结语
在本文中,我们列举了PA tag不仅可以用作纯化标签,还可以用作分子分析工具的应用实例。随着其用途的开发,PA tag有望用于各种各样的分析。例如,在晶体结构分析中,在膜蛋白等分子难以结晶化的情况下,通过与结合在柔性区域的特异性抗体片段(Fab,单链抗体等)形成复合物来促进结晶化,这一方法现已成为主流,但通常要获得针对单个靶蛋白的抗体,这将花费大量的时间和精力。然而,PA tag系统只需要在目标位置中插入标签,并与NZ-1片段形成复合物,就可以获得同样的效果。这些应用只能通过具有"高亲和力"和"可插入环区"的独特属性的PA tag系统才能够实现。我们希望PA tag系统能够发挥其特长并应用于多种研究领域。
参考文献
1)Nogi, T. et al. : Protein Sci., 17, 2120(2008).
2)Tabata, S. et al. : J. Proteomics, 73, 1777(2010).
3)Fujii, Y. et al. : Protein Expr. Purif., 95, 240(2014).
4)藤井勇樹 他 : 蛋白質科学会アーカイブ, 7, e075(2014).
5)Kato, Y. et al. :Biochem. Biophys. Res. Commun.,349, 1301(2006).
6)Fujii, Y. et al. : J. Cell Sci., 129, 1512(2016).
7)Guruprsad, K. andRajkumar, S. : J. Biosci., 25, 143(2000).
8)Zhu, J. et al. : Mol. Cell, 32, 849(2008).
9)Takagi, J. et al. : Cell, 110, 599(2002)
Note:
环区:改变多肽链的方向的弯曲结构。
转角结构:由3至4个氨基酸残基组成的U形二级结构。根据两个末端残基之间的距离和主链的二面角进行细分(A,β,γ,δ,π)。β-转角结构一般是最常见的。
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
016-25861 |
Anti PA tag, Rat Monoclonal Antibody(NZ-1) |
免疫化学用 |
200μL |
|
012-25863 |
1mL |
||
|
015-25951 |
Anti PA tag, Rat Monoclonal Antibody(NZ-1), Peroxidase conjugated |
免疫化学用 |
200μL |
|
011-25953 |
1mL |
||
|
012-25841 |
Anti PA tag Antibody Beads |
免疫化学用 |
2mL |
|
018-25843 |
10mL |
||
|
016-25844 |
50mL |
||
|
167-25501 |
PA tag Peptide |
基因研究用 |
5mg |
|
163-25503 |
25mg |
||
|
169-27261 |
PA tag Washing Solution |
基因研究用 |
50mL |
◆载体列表
| 产品名称(载体名称) | 抗性 | 规格 | 产品编号 | |
| 大肠杆菌抗性 | 真核细胞抗性 | |||
| pCAG-Ble PA tag-C | Bleomycin | 20 μg | 161-26861 | |
| pCAG-Ble PA tag-N Signal Plus | 20 μg | 168-26871 | ||
| pCAG-Bsd PA tag-C | Blasticidin S | 20 μg | 165-26881 | |
| pCAG-Bsd PA tag-N Signal Plus | 20 μg | 162-26891 | ||
| pCAG-Hyg PA tag-C | Hygromycin B | 20 μg | 165-26901 | |
| pCAG-Hyg PA tag-N Signal Plus | 20 μg | 162-26911 | ||
| pCAG-Neo PA tag-C | Kanamycin | G418 | 20 μg | 169-26921 |
| pCAG-Neo PA tag-N Signal Plus | 20 μg | 166-26931 | ||
