SuperSep Phos-tag™ 蛋白磷酸化预制胶-【本活动已结束】
【本活动已结束】
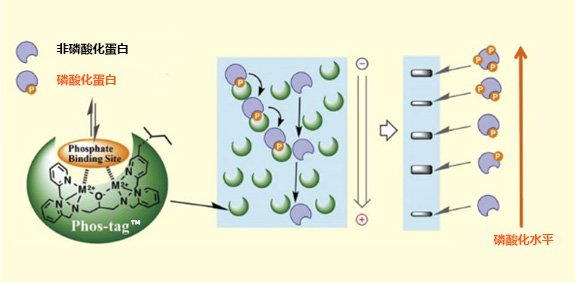
SuperSep Phos-tag™是研究蛋白磷酸化的方法,无需特异性磷酸化抗体或者同位素标记。
◆SuperSep Phos-tag™

Phos-tag™是一种预制胶,预先加入了50 μmol/L的Phostag™ Acrylamide,打开包装即可直接使用。预制胶中含有锌作为金属离子,在中心凝胶缓冲液中保存稳定性很好,得到的带条结果也很整齐。
磷酸化蛋白和非磷酸化蛋白作为不同条带分离。
分离后,胶可用于考马斯亮蓝染色,免疫印迹和质谱实验。
◆Phos-tag™ SDS-PAGE 的原理
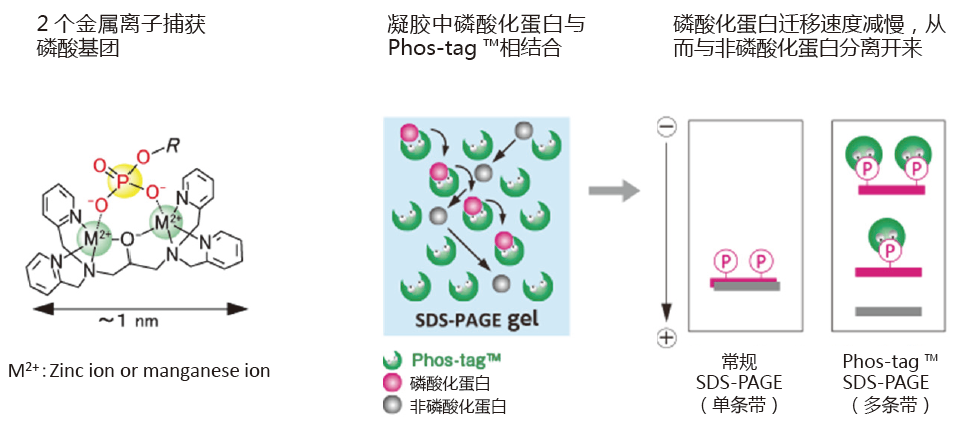
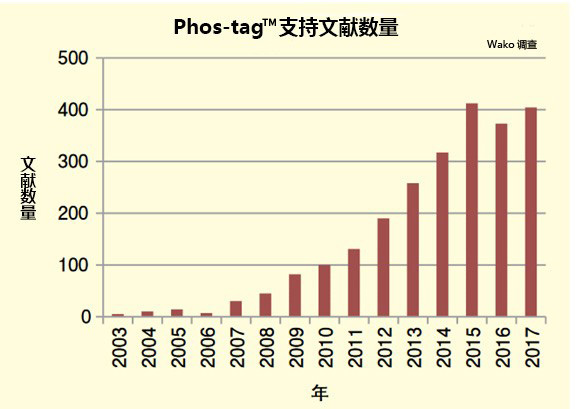
◆在HighWire Search 上搜索到的论文数
◆运用
利用p35的丙氨酸突变体确定Cdk5 激活p35的磷酸化位点
p35常见的磷酸化位点是Ser8和Thr138。但是Ser8和Thr138位点往往会发生丙氨酸突变,产生3种突变体(Ser8突变体:S8A,Thr138突变体:T138A,Ser8和Thr138双突变体:2A)。这3种突变体、野生型p35、Cdk5和没有激酶活性的Cdk5都来源于COS-7细胞。这些细胞裂解液用Phos-tag™ SDS-PAGE和Western blotting 进行检测(检测抗体:p35抗体)。

100 μM Phos-tag ™ 丙烯酰胺, 7.5% 聚丙烯酰胺凝胶
可明确磷酸化位点和条带迁移率的关系!
– 泳道1(条带L2和L4)和泳道5(条带M1):p35在Cdk5的作用下发生了磷酸化;
– 泳道1(条带L2和L4)和泳道3(条带L2和L4):在无激酶活性Cdk5的作用下,大约有一半p35蛋白在Thr138位点发生磷酸化,同样在138位发生突变的p35蛋白亦是如此。
– 泳道5 (条带M1)和泳道6(条带L3和L4):Ser8和Thr138是主要的磷酸化位点;
– 泳道5(条带M1)、泳道7(条带L1和L2)和泳道8(条带M2):条带M1是Ser8和Thr138都发生磷酸化的条带;条带M2是只有Ser8磷酸化的条带;条带L1和L2是只有Thr138磷酸化的条带。
※ 条带L1和L3中的X 是不确定哪个位点发生磷酸化的条带;
※ 条带L4是非磷酸化的p35。
【参考文献】
Quantitative Measurement of in Vivo Phosphorylation States of Cdk5 Activator p35 by Phos-tag ™ SDS-PAGE. T. Hosokawa, T. Saito, A. Asada, K. Fukunaga, and S. Hisanaga,Mol. Cell. Proteomics, Jun 2010;9: 1133 – 1143.
【结果提供】
理化学研究所 脑科学综合研究中心 回路功能研究核心 记忆功能研究团队 细川智永(Dr. T. Hosokawa)
首都大学东京 理工学研究科 生命科学专业 神经分子功能研究室 久永真市(Dr. S. Hisanaga)
检测含有Dnmt1磷酸化激酶的片段
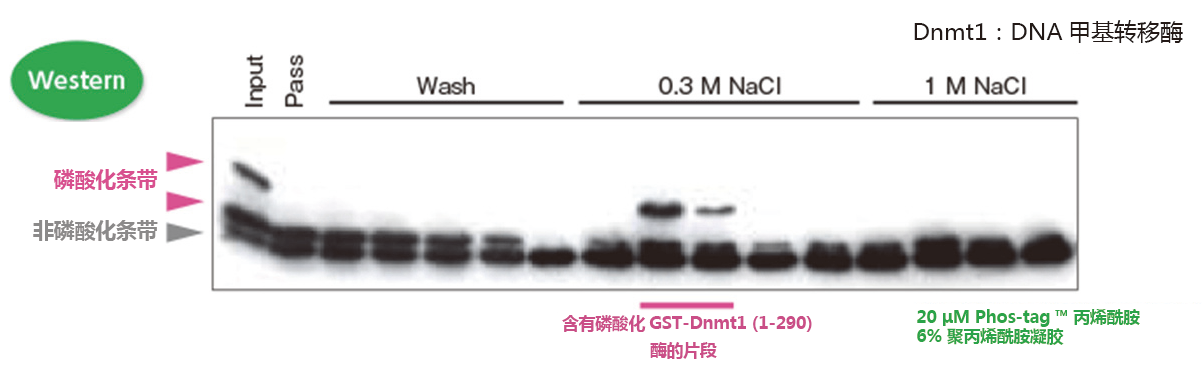
我们可以确定在片段中含有目的激酶!
① 采用亲和色谱法从鼠脑提取液中纯化GST-Dnmt1(1-290)结合蛋白
② 使用0.3 M 和1 M NaCl 的DNA 纤维素柱洗脱得到目的蛋白
③ GST-Dnmt1(1-290)作为体外激酶实验的反应底物
④ Phos-tag ™ SDS-PAGE 用于Western blotting,确定迁移条带中每个片段的激酶活性
【参考文献】
The DNA-binding activity of mouse DNA methyltransferase 1 is regulated by phosphorylation with casein kinase 1delta/epsilon. Y. Sugiyama, N. Hatano, N. Sueyoshi, I. Suetake, S. Tajima, E. Kinoshita, E. Kinoshita-Kikuta, T. Koike, and I. Kameshita, Biochem. J.,
【结果提供】
高知大学 综合研究中心 生命、功能物质部门 实验实习机器设施 杉山康宪(Dr. Y. Sugiyama)
香川大学 农学部 应用生物科学科 动物功能生化学研究室 龟下勇(Dr. I. Kameshita)
二维电泳中的应用:分析hnRNP K磷酸化异构体
小鼠巨噬细胞J774.1 经LPS 刺激后,裂解细胞,经过免疫沉淀法分离得到hnRNP K。在二维电泳中,一维是IPG 胶,二维是Phos-tag ™ SDS-PAGE,可分离hnRNP K 的异构体。利用质谱仪,可以确认不同的点代表不同的亚型或修饰蛋白。
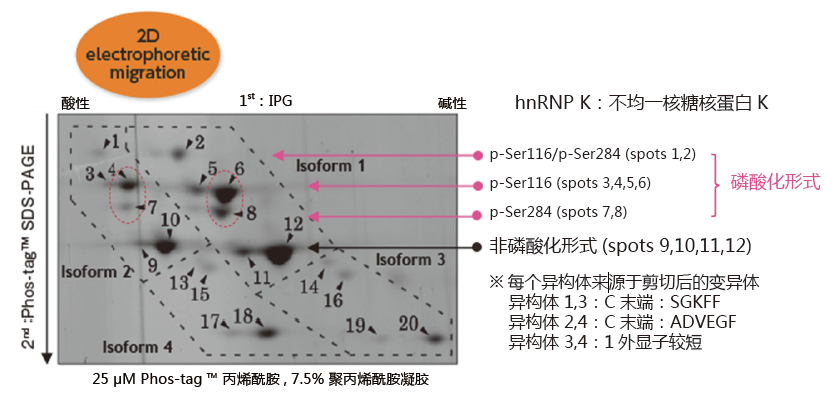
同一个等电点的位置上,不同位点发生磷酸化都可以被区分开来
(例: spots 6 vs. 8 and spots 4 vs. 7)
【参考文献】
Characterization of multiple alternative forms of heterogeneous nuclear ribonucleoprotein K by phosphate-affinity electrophoresis. Y. Kimura, K. Nagata, N Suzuki, R. Yokoyama, Y. Yamanaka, H. Kitamura, H. Hirano, and O. Ohara, Proteomics, Nov 2010; 10(21): 3884-95.
【结果提供】
横滨市立大学 生命纳米系统科学研究科 生物体超分子系统科学专业 木村弥生(Dr. Y. Kimura)、平野久(Dr. H. Hirano)
理化学研究所RCAI 小原收
◆备注
样品制备:
Phos-tag SDS-PAGE对于蛋白样品中的杂质非常敏感,尤其是螯合剂,钒酸,无机盐,表面活性剂这类物质。
强烈建议在Phos-tag SDS-PAGE之前通过TCA沉淀或渗析法降低杂质含量。
转膜前处理:
另一个必须的步骤是在转膜前,用EDTA去除凝胶中的金属离子(Mn2+或者Zn2+);
该步骤可提高蛋白的转膜效率。
● 分别准备10 mmol/L 含EDTA和不含EDTA 两种1x transfer buffer。
● 将凝胶浸泡在含10 mmol/L EDTA的1x transfer buffer,至少20分钟,温和摇晃。更换新缓冲液,重复3次。
● 将凝胶浸泡在不含10 mmol/L EDTA的1x transfer buffer,10分钟,温和摇晃。
● 转膜操作*。
* 建议用湿法转膜,以提高转膜效率。

◆质量控制
每一批SuperSep Phos-tag™,出厂前均根据其产品规格进行测试,以保证可分离磷酸化和非磷酸化蛋白,以及他们的分离成都在正常参数内。
◆产品信息
产品编号
|
产品名称
|
规格
|
| 192-18001-EA-S |
SuperSep™ Phos-tag™ (50μmol/l), 7.5%, 17well, 100×100×6.6mm
Phos-tag 预制胶50μmol/l,7.5%,17孔,Life Technologies型
|
1块
|
| 198-17981-EA-S |
SuperSep™ Phos-tag™ (50μmol/l), 7.5%, 17well, 83×100×3.9mm
Phos-tag 预制胶50μmol/l,7.5%,17孔,BioRad型
|
1块 |
更多产品详情请点击此处