第四回 BDNF/TrkB信号的另一面
阐明BDNF-从基础到临床-

昭和大学 医学部 安达直树
◆前言
回顾本系列第三回,BDNF/TrkB信号在神经回路的正常发育以及神经传导的调节中可发挥有益的作用。因此BDNF/TrkB信号受损会导致脑部疾病,以激活BDNF/TrkB信号为目的的药物研发也不在少数。本文将对具体的事例进行分析,探讨BDNF/TrkB信号的功能是否会成为威胁我们健康的“敌人”。
首先再次确认一下主要的BDNF/TrkB信号通路,并介绍其如何参与个别疾病。
◆BDNF/TrkB信号通路
MAPK/ERK通路
在激活TrkB受体的Tyr490和Tyr515残基,Shc衔接蛋白便会停靠在这些酪氨酸位点上,并招募Grb2(Growth factor receptor-bound protein 2)与GTPase Ras形成复合体,然后激活MAPK(mitogen activated protein kinase)/ERK(extracellular signal regulated kinase)通路。MAPK/ERK激酶通过磷酸化激活转录因子CREB(cAMP response element binding protein)。磷酸化的CREB移动到细胞核内,通过与各种基因的启动子结合来调节转录,促进细胞的存活、分化和增殖。
PI3K/Akt通路
PI3(Phosphoinositide 3)激酶通路的激活,通过摄入Tyr515残基的Ras复合体,使PI3K/Akt通路和MEK/MAPK通路等多个级联反应激活。激活PI3K/Akt级联反应能够控制神经细胞存活、生长和分化所必须的蛋白。
PLCγ通路
TrkB受体的Tyr816残基磷酸化后,会激活PLCγ(phospholipase Cγ)通路,生成IP3和DAG(diacyl glycerol)。PLCγ/IP3通路会导致内质网的钙释放并激活CaMKⅡ(Ca2+/calmodulin-dependent protein kinaseⅡ),由此激活CREB磷酸化。另一方面,DAG的生成也会激活PKC(Protein kinase C)。CaMKII・PKC的激活作用于细胞的存活、神经突伸长和突触可塑性。
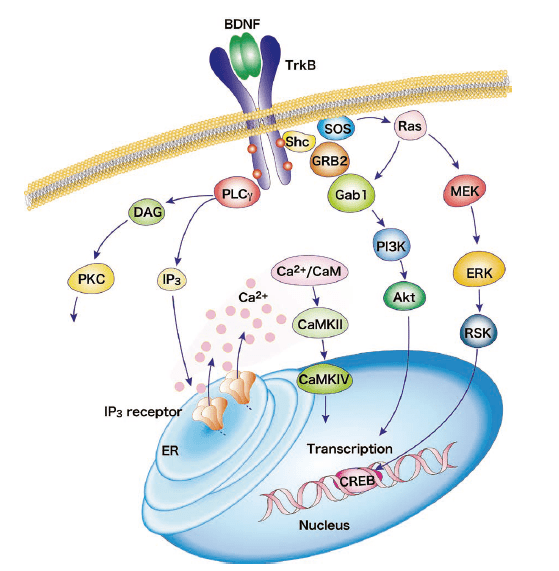
图.BDNF/TrkB信号通路改编自参考文献37)
◆药物成瘾中的BDNF/TrkB信号
BDNF/TrkB信号能够促进大脑“奖励机制“这一神经回路的可塑性变化,因此被认为与可卡因成瘾等药物成瘾有关1)。在负责奖励机制的大脑区域的基态下,BDNF于腹侧被盖区(VTA)、小脑扁桃体、海马体、前额皮层中呈高表达状态,但在背侧纹状体和伏隔核(NAc)中呈低表达状态2)。
与此相对的,TrkB在整个大脑中广泛表达3)。对啮齿动物的研究表明,可卡因能够提高奖励机制相关区域的BDNF水平4,5)。另外在可卡因成瘾的动物模型中,通过向VTA和NAc注射BDNF以及强制表达BDNF/TrkB,能够增强条件性位置偏好、可卡因探索行为和戒断反应。注射抗BDNF的抗体或进行BDNF/TrkB敲断可抑制这些行为6)。
模型中显示,可卡因导致的NAc等的BDNF/TrkB信号增强,会通过转录和翻译水平调节AMPA型谷氨酸受体亚基的组成,从而引起突触的可塑性变化,参与成瘾症状1)。另一方面,在啮齿动物的研究中发现,内侧前额叶皮层(mPFC)的BDNF/TrkB信号增强能够抑制可卡因成瘾症状7),因此如果以抑制BDNF/TrkB信号为靶点的可卡因成瘾治疗限定在NAc和VTA区域的话,或许可以充分发挥其功效。
◆慢性疼痛中的BDNF/TrkB信号
疼痛的感官刺激由背根神经节神经元成为初级传入神经,并向存在于脊髓背角的次级神经元发送兴奋性输入进行传递。然而,脊髓背角神经元的兴奋性增加也是引起神经性疼痛的主要因素。研究认为,脊髓背角的BDNF/TrkB信号增强会通过以下3个机制参与神经性疼痛的发病和进展。
① KCC2
脊髓中存在着两种不同的抑制机制,分别是初级传入神经的突触前抑制和背角投射神经元的突触后抑制,这两种不同的抑制机制控制着疼痛信号。BDNF参与这种抑制性 GABA 能突触的调节,引起痛觉过敏8)。这里的关键是potassium chloride co-transporter 2 (KCC2)的功能。KCC2是一种跨膜蛋白,能够通过泵出氯离子(Cl–)来提高细胞外的Cl–浓度,并使接受了GABA的突触后细胞在GABA受体开口时超级化,是一种可以确保GABA抑制性的泵9)。
在神经性疼痛的动物模型中,脊髓背角中的BDNF表达上升,KCC2蛋白的表达下降10)。而且,通过鞘内给药TrkB/Fc嵌合体或TrkB抑制剂K252a,可以阻断由神经损伤导致的脊髓背角KCC2表达下调,从而缓和神经性疼痛11)。虽然细节尚未明确,但在BDNF/TrkB信号中,Shc通路和PLCγ通路串联激活时,也会引起KCC2的转录抑制12)。
② 兴奋性增强
在神经损伤的动物模型中,BDNF引发的TrkB受体激活,可通过增加突触前位点谷氨酸突触小泡的蓄积来增强突触的传递,或通过强化NMDA型受体的功能来诱导神经性疼痛的发作13)。研究认为,如果脊髓背角神经元的TrkB受体与BDNF结合,通过Fyn激酶对GluN2B(NR2B)亚基的磷酸化来诱导背根神经节神经元-脊髓背角神经元间的突触长期增强,就能引起中枢敏化和神经性疼痛14,15)。
③ 激活胶质细胞
上述内容介绍了通过BDNF提高脊髓背角神经元的兴奋性从而引起神经性疼痛的机制。那么,在受到神经损伤时首先供应BDNF的是哪个细胞呢?至今为止的研究表明,BDNF的来源是胶质细胞。
由周围神经损伤等激活的小胶质细胞会生成并释放大量的细胞因子(IL-2、TNF-α、BDNF等),通过诱导神经炎症反应和神经免疫应答,在痛觉过敏的发病机制中起重要作用16)。在活化后的小胶质细胞中的BDNF表达会增加,细胞迁移也会变活跃、还会增加TNF-α的释放量17)。此外,由于外源性BDNF可活化小胶质细胞,促进细胞游走与TNF-a的释放,所以神经损伤时小胶质细胞由来的BDNF会对自身产生作用,使自己进一步被活化的这一正反馈机制也可能会存在18)。
另外,激活脊髓背角中的星形胶质细胞也能使BDNF和炎症细胞因子水平上升19),因此星型胶质细胞也被认为是持续性中枢敏化的主要组成成分20)。BDNF的生成和释放原本是为了保护神经细胞并促进细胞生存,那么作为对急性危险因素(神经损伤等)的应答,BDNF生成和释放的增加应具有生物的适应性。但由于缺少负反馈机制,所以伴随着神经性疼痛的病情发展,中枢神经系统可能会变为非适应性状态。
◆癫痫中的BDNF/TrkB信号
如今,世界人口的约0.5~1%为癫痫患者,癫痫是由大脑细胞群突发性过度活跃而引起的一种慢性进行性中枢神经系统疾病21)。癫痫的特征是自发性的反复发作,并导致暂时性的脑功能障碍以及神经系统损伤、认知能力降低等一系列严重的症状22)。
临床研究表明,大部分癫痫患者血清中的BDNF值要高于正常人(Iughetti团队,2018年)(Demir团队,2020年)。另外,在癫痫动物模型中,BDNF和TrkB在颞叶和海马区明显增加23)。在此类癫痫小鼠模型中,通过让TrkB缺失24)或短暂地阻碍TrkB受体25),能够让癫痫小鼠的发病率显著下降。此外,向大鼠的海马区给药BDNF可诱导癫痫发作26)。
那么BDNF/TrkB信号如何参与癫痫发病?目前提出的机制主要有3种。① BDNF诱导兰尼碱受体介导的Ca2+释放和活性氧(ROS)产生27),促进神经细胞的损伤和细胞凋亡28)。② 通过提高TrkB的激活使KCC2的表达降低,从而降低GABA神经元产生的抑制效果25)。③ BDNF/TrkB信号增强会引起海马齿状回颗粒细胞的轴突——苔藓纤维的异常发芽,从而导致大脑异常兴奋回路的形成29)。
关于BDNF/TrkB在癫痫发病中的确切作用,从各个方面来看都还有待讨论,比如BDNF的表达量、在脑中表达的部位以及上游和下游分子等的关系等等。但BDNF/TrkB信号传导通路中所包含的大量蛋白和分子,被期待作为临床癫痫检测和治疗的靶点,希望今后能将其有效运用于癫痫的临床治疗、风险评估以及预后预测等方面。
◆癌症中的BDNF/TrkB信号
研究显示,BDNF/TrkB信号可以促进细胞的癌变、浸润和转移,同时也是导致产生化疗抗性的原因。
如果将TrkB过量表达的神经嵴来源细胞株移植到小鼠体内,10天后就会形成一个快速生长的肿瘤,小鼠在肿瘤形成后的7天内全部死亡30)。另外,脑肿瘤细胞会过量表达TrkB,只要它还在产生BDNF,即使缺少EGF等原有的生长因子也可以存活。所以,研究人员认为其在自分泌中获得了维持自身生存的能力31)。
肿瘤治疗的难点主要在于其会向其他内脏发生转移。从肿瘤细胞来看,转移就是为了生存而进行的活动。它们需突破由离开细胞外基质引起的细胞死亡(细胞凋亡)障碍32),并改变基因表达,从上皮细胞转化为间充质表型细胞(上皮间充质转化),再承受通过血液转移到其他内脏的过程才能生存下来32,33)。
有趣的是,肿瘤细胞似乎还能通过激活TrkB来使PI3激酶长期处于激活状态,由此提高对失巢凋亡的抗性和转移的成功率32,33)。虽然本文没有详细介绍相关机制,但从BDNF/TrkB信号可对内源性或外源性的细胞凋亡起抑制作用可以了解到,其对抗癌药剂化疗具有抵抗性34)。
BDNF/TrkB信号在参与癌症的形成、转移和治疗抗性的同时,也有报告指出其”有益“的功能。被移植了黑色素瘤的小鼠在环境富集(放于有许多玩具的笼里饲养)的条件下,自然杀伤细胞以及T细胞的杀伤性增强,肿瘤的生长受到明显抑制35,36)。环境富集小鼠的下丘脑中BDNF的表达增加,而敲除此BDNF就会使环境富集诱发的肿瘤抗性消失35)。此结果表明,下丘脑中的BDNF升高是环境富集引起的抗肿瘤作用的关键。
◆结语
本文介绍了BDNF/TrkB信号对我们健康有害的“另一面”。基本上通过BDNF与TrkB结合,激活各类细胞内信号级联反应,然后调节突触传递、促进细胞的生存和增殖,这些方面和发挥有益功能的情况一样。然而,BDNF/TrkB信号在异位或过度激活的情况下就会对我们的健康构成威胁。
BDNF在针对脑部疾病和功能障碍的治疗效果,以及通过下丘脑介导的抗癌作用等方面备受期待。因此,以提高大脑中BDNF的表达为目的,研究人员开始研发提高AMPA型谷氨酸受体反应的变构调节剂(统称为ampakine)。某种ampakine在急性给药几天内就能使几个大脑区域中的BDNF产生量增加20倍,但意外发作原性作用使这类药剂难以应用于临床。然而近来有报告显示,能够改善随着年龄增长而导致的记忆障碍且无阵发性副作用的第一支ampakine已经问世36),为研究界带来了一丝曙光。
本次通过聚焦BDNF/TrkB信号消极的一面,相信已经让各位再次了解到BDNF/TrkB信号在合适的区域内进行适度激活的必要性以及积累基础研究对临床应用的重要性。
◆参考文献
1. Li, X. and Wolf, M. E. : Behav. Brain Res., 279, 240 (2015).
2. Conner, J. M. et al. : J. Neurosci., 17, 2295 (1997).
3. Krause, S. et al. : J. Neurosci. Res., 86, 411 (2008).
4. Graham, D. L. et al. : Nat. Neurosci., 10, 1029 (2007).
5. Horger, B. A. et al. : J. Neurosci., 19, 4110 (1999).
6. Bahi, A. et al. : Psychopharmacology (Berl), 199, 169 (2008).
7. Berglind, W. J. et al. : Eur. J. Neurosci., 26, 757 (2007).
8. Malan, T. P. et al. : Anesthesiology, 96, 1161 (2002).
9. Janssen, S. P. et al. : Neurochem. Int., 60, 21 (2012).
10. Malcangio, M. : Neurobiol. Pain, 1, 1 (2017).
11. Yajima, Y. et al. : J. Neurochem., 93, 584 (2005).
12. Lee-Hotta, S. et al. : Neurochem. Int., 128, 32 (2019).
13. Wang, L. N. et al. : J. Neurosci. Res., 90, 1249 (2012).
14. Li, S. et al. : Neurochem. Res., 42, 2712 (2017).
15. Ding, X. et al. : Neurobiol. Dis., 73, 428 (2015).
16. Tsuda, M. et al. : Trends Neurosci., 28, 101 (2005).
17. Zhang, X. et al. : Cell. Physiol. Biochem., 34, 715 (2014).
18. Zhou, W. et al. : Neurosci. Lett., 756, 135965 (2021).
19. Chiang, C. Y. et al. : Neurochem. Res., 37, 2419 (2012).
20. Liu, T. et al. : Neurosci. Bull., 28, 131 (2012).
21. Fisher, R. S. et al. : Epilepsia, 55, 475 (2014).
22. Thijs, R. D. et al. : Lancet, 393, 689 (2019).
23. Wang, X. et al. : Front. Pharmacol., 12, 758232 (2021).
24. He, X. P. et al. : Neuron, 43, 31 (2004).
25. Liu, G. et al. : Neuron, 79, 31 (2013).
26. Scharfman, H. E. et al. : Exp. Neurol., 174, 201 (2002).
27. Yang, N. et al. : Oxid. Med. Cell. Longev., 2020, 6687185 (2020).
28. Ghadiri, T. et al. : Neurosci. Lett., 709, 134384 (2019).
29. Skupien-Jaroszek, A. et al. : PLoS One, 16, e0239111 (2021).
30. Yin, B. et al. : Oncogene, 34, 761 (2015).
31. Lawn, S. et al. : J. Biol. Chem., 290, 3814 (2015).
32. Bao, W. et al. : PLos One, 8, e70616 (2013).
33. Kupferman, M. E. et al. : Oncogene, 29, 2047 (2010).
34. Radin, D. P. and Patel, P. : Anticancer Res., 37, 3983 (2017).
35. Cao, L. et al. : Cell, 142, 52 (2010).
36. Radin, D. P. et al. : Biomed. Pharmacother., 84, 806 (2016).
37. Numakawa, T. et al. : World J. Biol. Chem., 1, 133 (2010).
点击此处查看相关产品:Mature BDNF ELISA试剂盒 Wako
![]()