抗 CD40(小鼠),单克隆抗体(FGK45)
- 产品特性
- 相关资料
- Q&A
- 参考文献
 抗 CD40(小鼠),单克隆抗体(FGK45)
抗 CD40(小鼠),单克隆抗体(FGK45)
CD40 属于 TNF 受体超家族,并且介导广泛的免疫和炎症反应,包括T细胞依赖性免疫球蛋白类别转换,记忆B细胞发育和生发中心形成。 CD40-CD40L 的相互作用对 β-淀粉样蛋白诱导的小胶质细胞活化是必需的,因此被认为是阿尔茨海默病发病机制中的早期表现。CD40 由抗原呈递细胞组成型表达,包括树突细胞、B 细胞和巨噬细胞。与其在正常细胞上的广泛表达一致,CD40 也广泛在肿瘤细胞上表达,包括非霍奇金和霍奇金淋巴瘤,骨髓瘤和一些癌症,如鼻咽癌、膀胱癌、子宫颈癌、肾癌和卵巢癌。
◆产品描述
别名:肿瘤坏死因子受体超家族成员5; CD40L 受体
产品类型:单克隆抗体
◆特性
克隆号:FGK45
亚型:大鼠 IgG 2a
来源/宿主:从浓缩的杂交瘤组织培养上清液中纯化。
免疫原/抗原:重组小鼠 CD40 融合蛋白。
应用:流式细胞仪
功能性应用:激活体内和体外 B 细胞和 NK 细胞。对于体内研究,使用不含防腐剂的抗体(产品编号 AG-20B-0036PF)。
交叉反应性:小鼠
特异性:识别小鼠 CD40。
纯度:≥95%(SDS-PAGE)
纯度方法:蛋白G亲和纯化。
内毒素含量:<0.01 EU/μg 纯化蛋白(LAL测试;Lonza)。
浓度:1 mg/mL
配方:液体。保存在含 0.02% 叠氮化钠的 PBS 中。
其他产品数据:广泛用于 CD40 的刺激性单克隆抗体。间接激活自然杀伤性细胞(NK),产生显著的抗肿瘤和抗转移作用。有效增强对传染源的免疫应答,并有可能用在治疗慢性自身免疫性炎症的过程发挥潜在作用。
运输和保存
运输:干冰
短期储存: 4℃
长期储存:-20℃
处理建议:开封后,请分装保存在 -20℃。避免反复冻融。
使用/稳定性:收到产品后保存于 -20℃,有限期至少 1 年。
参考文献
| [1] | The SCID but not the RAG-2 gene product is required for S mu-S epsilon heavy chain class switching: A. Rolink, et al.;Immunity 5, 319 (1996) |
| [2] | Characterization of immature B cells by a novel monoclonal antibody, by turnover and by mitogen reactivity: A.G. Rolink,et al.; Eur. J. Immunol. 28, 3738 (1998) |
| [3] | Anti-CD40 antibody induces antitumor and antimetastatic effects: the role of NK cells: J.G. Turner, et al.; J.Immunol. 166, 89 (2001) |
| [4] | Therapeutic activity of agonistic monoclonal antibodies against CD40 in a chronic autoimmune inflammatory process: C.Mauri, et al.; Nat. Med. 6, 673 (2000) |
| [5] | Ovarian insufficiency and early pregnancy loss induced by activation of the innate immune system: A. Erlebacher, et al.;J. Clin. Invest. 114, 39 (2004) |
| [6] | CD154 is a negative regulator of autoaggressive CD8+ T cells in type 1 diabetes: C.M. McGregor, et al.; PNAS 101, 9345(2004) |
| [7] | IRF-7 is the master regulator of type-I interferon-dependent immune responses: K. Honda, et al.; Nature 434, 772(2005) |
| [8] | In vivo and in vitro regulation of type I IFN synthesis by synergistic effects of CD40 and type II IFN: J.A. Greene, et al.; J. Immunol. 176, 5995 (2006) |
| [9] | IL-10- and IL-12-independent down-regulation of allergic sensitization by stimulation of CD40 signaling: P.W. Hellings, et al.; J. Immunol. 177, 5138 (2006) |
| [10] | Agonistic Anti-CD40 Antibody Profoundly Suppresses the Immune Response to Infection with Lymphocytic Choriomeningitis Virus:C. Bartholdy, et al.; J. Immunol. 178, 1662 (2007) |
| [11] | Excessive interferon-α signaling in autoimmunity alters glycosphingolipid processing in B cells: A. Hee-Meng Tan, et al.;J. Autoimmun. in press (2017) |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| AG-20B-0036-C100 | anti-CD40 (mouse), mAb (FGK45) 抗小鼠CD40单克隆抗体(FGK45) |
100 μg | – | – |
| AG-20B-0036-C500 | anti-CD40 (mouse), mAb (FGK45) 抗小鼠CD40单克隆抗体(FGK45) |
500 μg | – | – |

 回到小鼠生殖工程学技术指南目录
回到小鼠生殖工程学技术指南目录
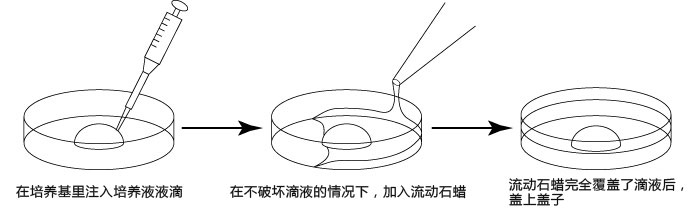
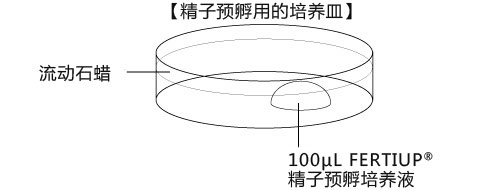
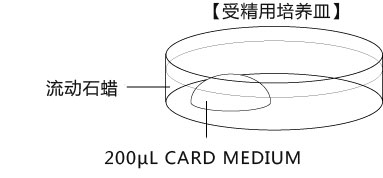
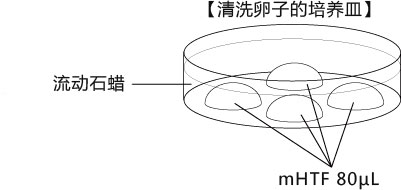
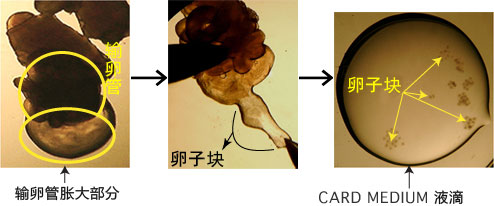
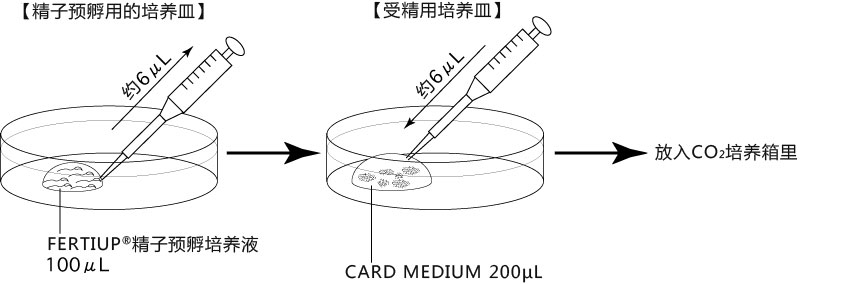
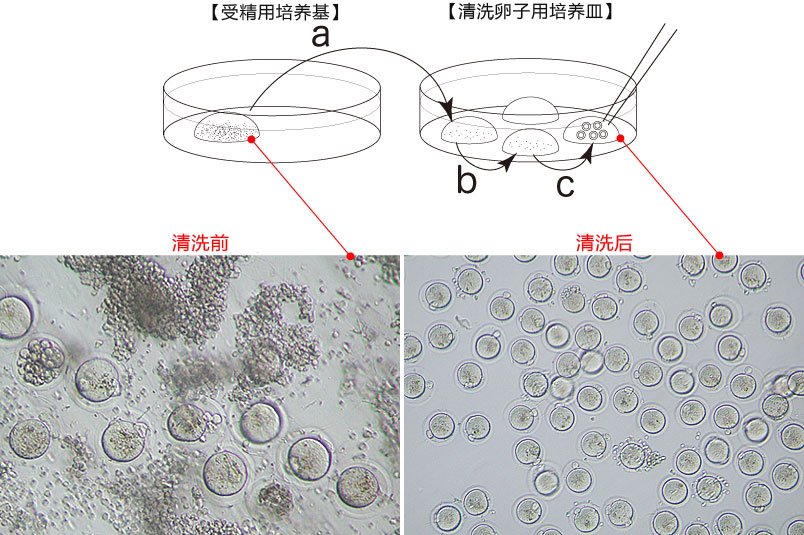
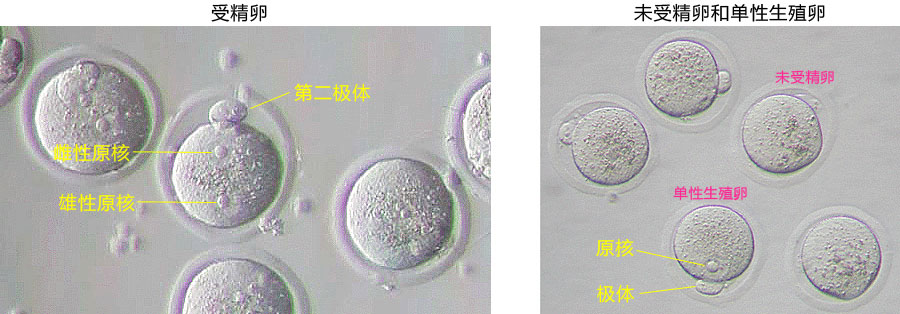

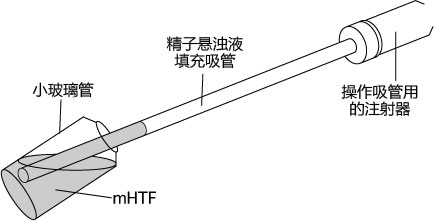
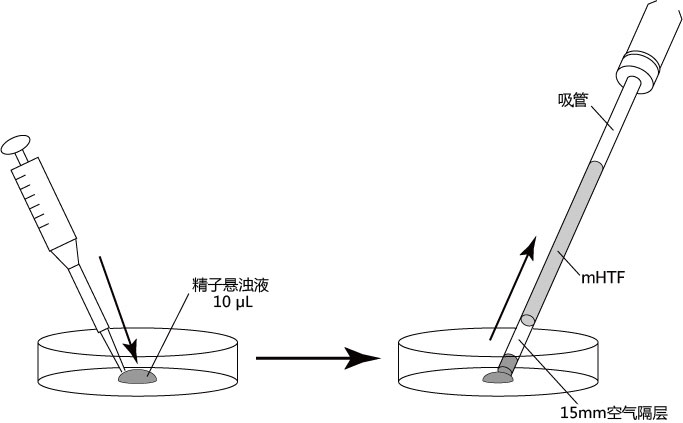
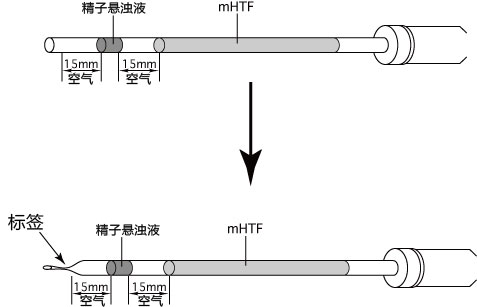
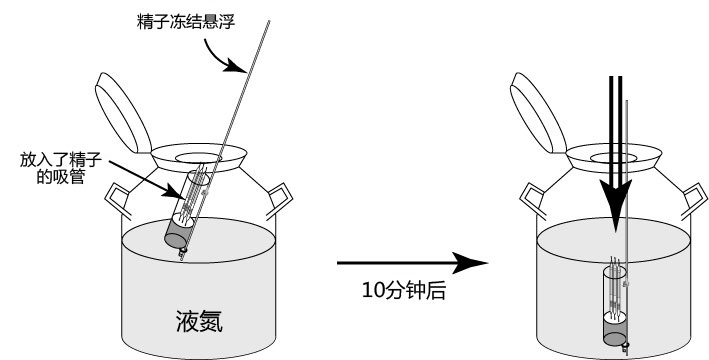

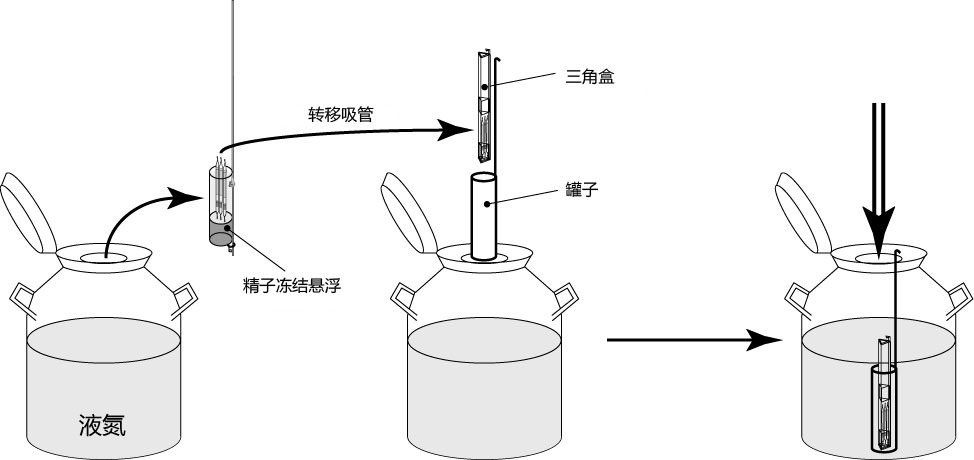
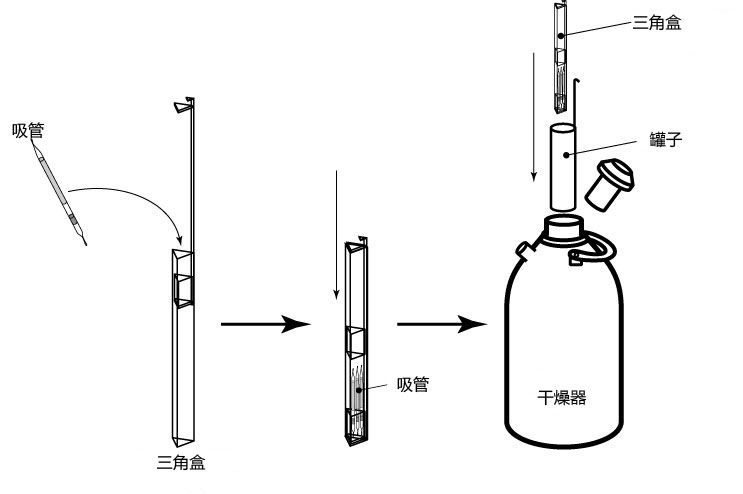

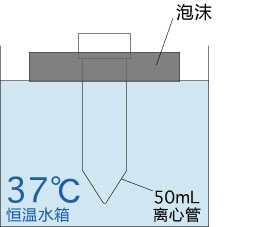
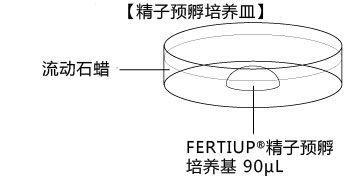
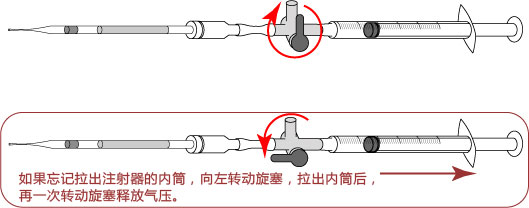
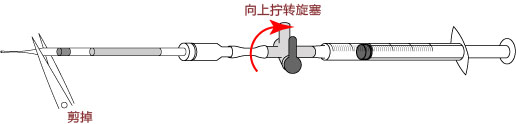
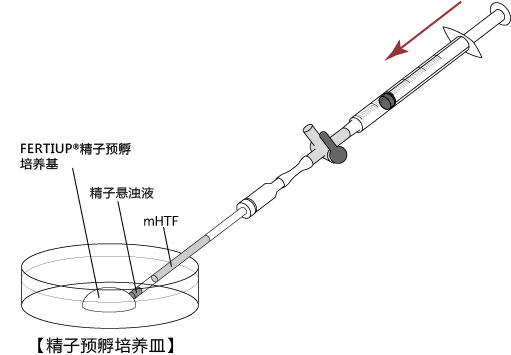
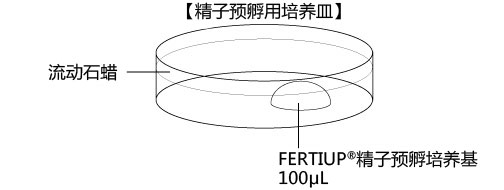
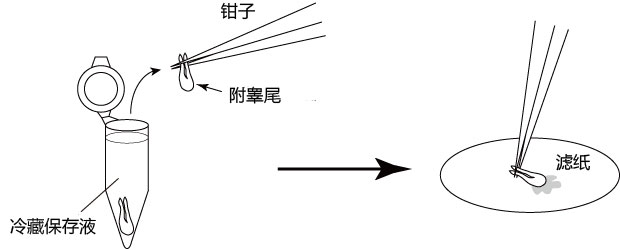
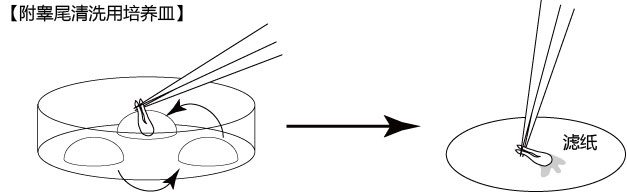
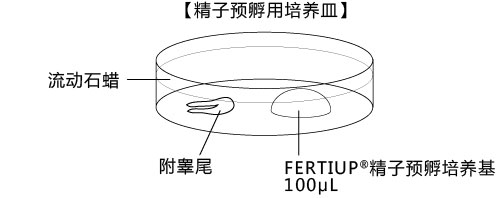














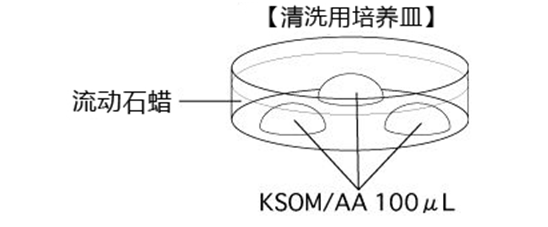
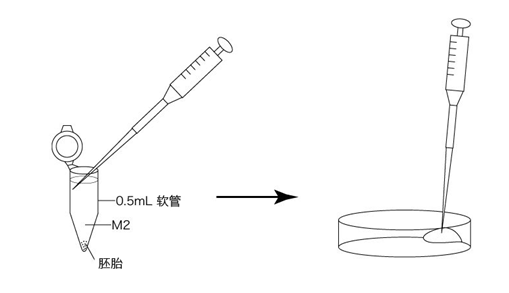
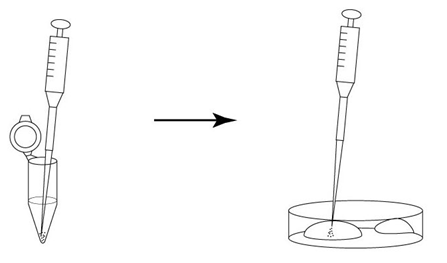
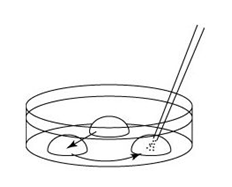
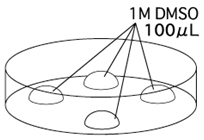
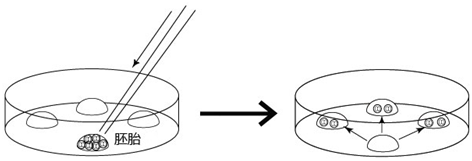
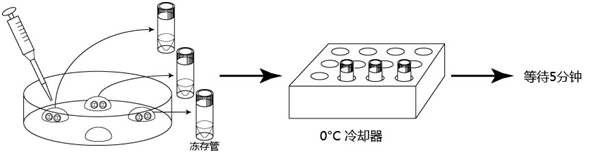

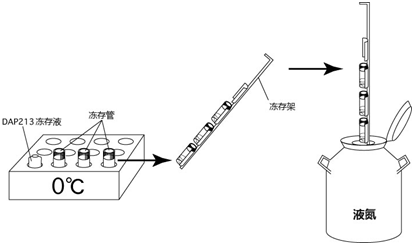


 →clip applicator
→clip applicator