小鼠生殖工程学技术——6体外受精
 回到小鼠生殖工程学技术指南目录
回到小鼠生殖工程学技术指南目录

 回到小鼠生殖工程冻存及培养试剂
回到小鼠生殖工程冻存及培养试剂
◆材料
1. 生理盐水生理盐水(大塚制药 日本药典 大塚生注食)
2. PMSG(asuka制药 注射血清促性腺激素 动物用性腺激素1000单位/管)
3. hCG(asuka制药 注射用胎盘促性腺激素,动物用性腺激素3000单位/管)
4. 1 mL注射器(泰尔茂株式会社SS-01T2613S)
5. FERTIUP® 精子预孵培养基(Cosmo Bio Co., Ltd)
6. CARD MEDIUM®(Cosmo Bio Co., Ltd)
7. mTHF(Cosmo Bio Co., Ltd)
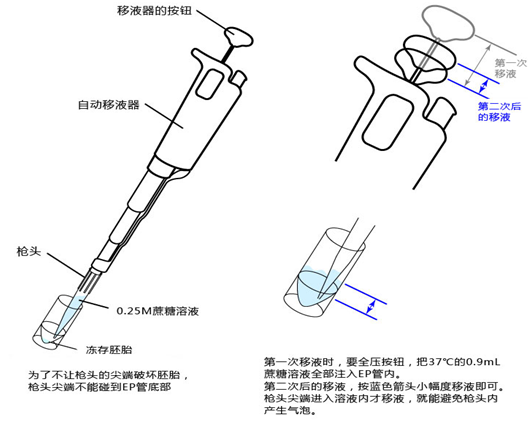
8. 电动移液器(法国吉尔森电动单道移液器P-200 P-20)
9. 黄色枪头 (BM医疗器 Cat.No.110-96R)
10. 受精用的枪头(Quality Scientific Plastics Pipet Tip Cat.No.114)
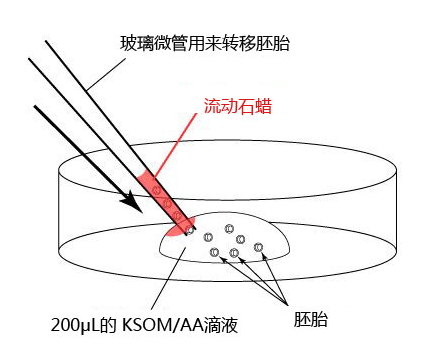
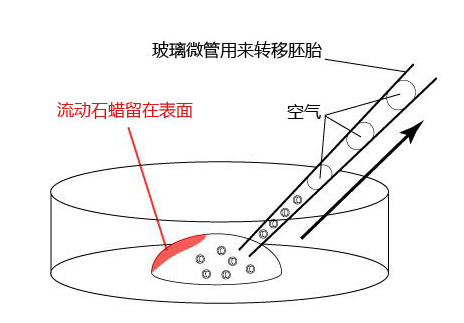
11. 流动石蜡(Nacalai Tesque Cat.No.26137-85)
12. 培养皿(Corning 35mm X 10mm Cat.No.430588)
13. 解剖用大剪刀 (夏目制造所 反剪刀 Cat.No.B-2)
14. 解剖用小剪刀 (夏目制造所 小直剪刀Cat.No.B-12)
15. 解剖用大钳子(夏目制造所 无钩尖细的镊子 Cat.No.A-5)
16. 解剖用小钳子 (夏目制造所 尖镊子 Cat.No.A-45)
17. noesu剪刀(森田制造所 电话03-3811-9730 特别订制品)

18. 解剖针(夏目制造所 Broach holderCat.No.E-14)
19. 滤纸
20. 微管
22. 倒置显微镜
23. CO2培养箱
◆方法
过量排卵处理
1. 把激素(PMSG 和hCG) 溶于37单位/mL的生理盐水中
1. * 激素溶液在4°C下,可保存2周
2. 成年雄性小鼠(8~12周龄)需腹腔注射2次,第一次注射PMSG0.2 mL(7.5単位)/只,48小时后,第二次注射hCG 0.2 mL(7.5单位)/只,然后进行过量排卵处理。(通常最好在下午5~6点期间注射激素)
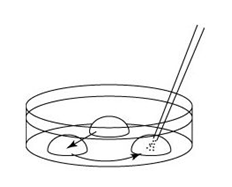
滴液准备
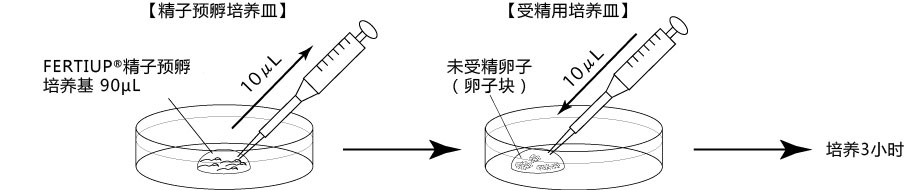
1. 按以下步骤,制作滴液(a、b、c),并静置在二氧化碳培养箱里,令气流稳定。
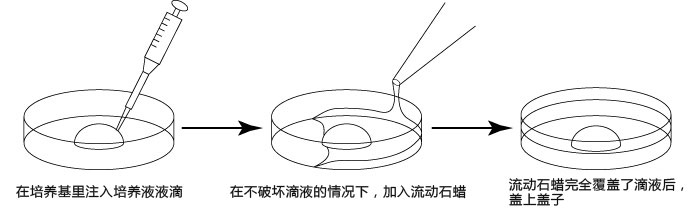
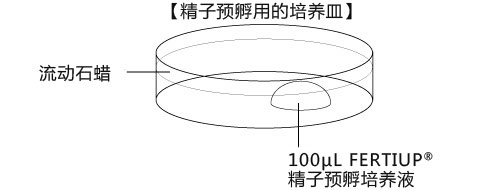
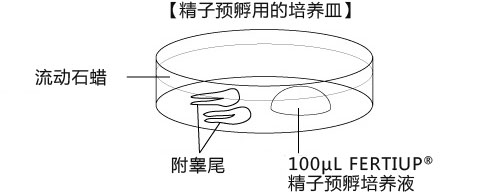
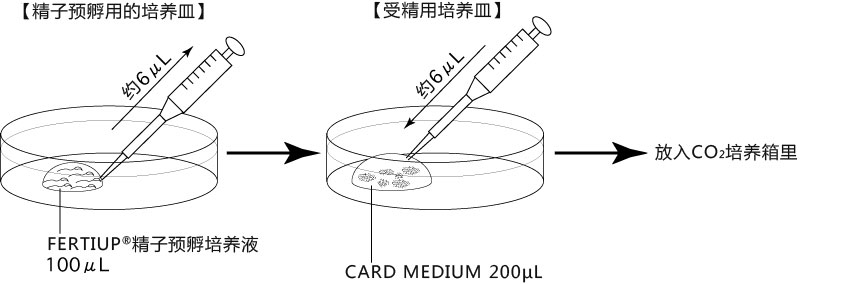
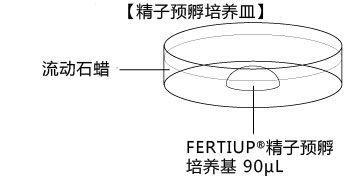
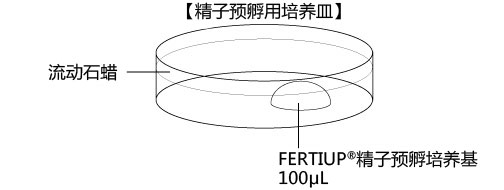
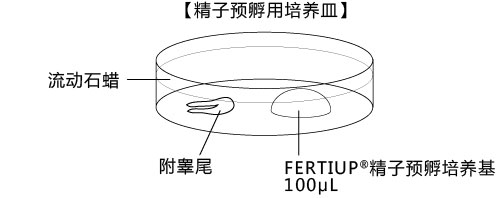
a 在解冻精子前30分钟,制作个精子孵育用的培养皿(100 μL FERTIUP® 精子预孵培养基液滴),准备静置在培养箱里;
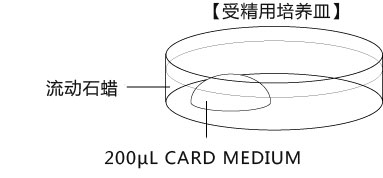
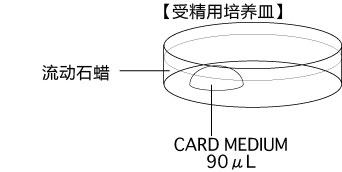
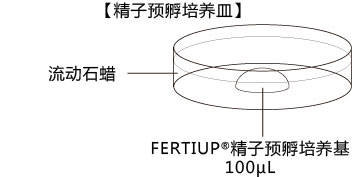
b 取卵前10分钟,制作受精用培养皿(200 µLCARD MEDIUM滴液1个),静置在培养箱里体外受精时,根据所用精子的不同有不一样的调试方法,详情请参考产品说明书。
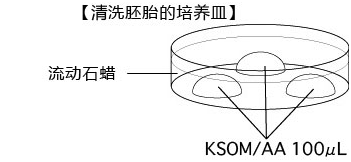
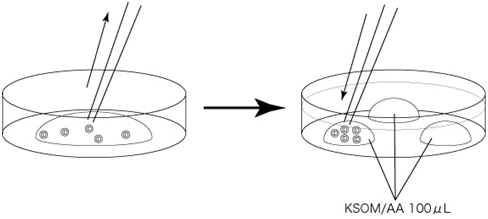
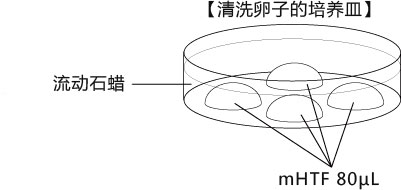
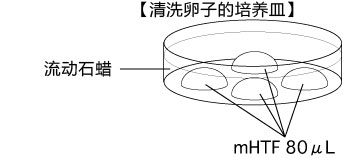
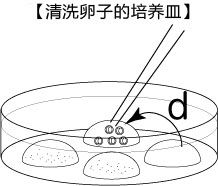
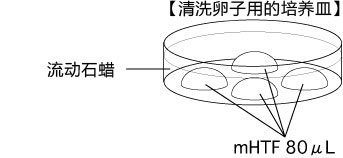
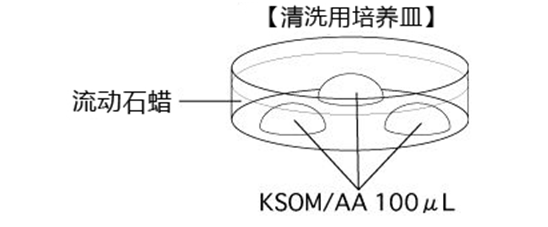
C 制作清洗卵子用的培养皿(80 µLmHTF滴液4个),在培养箱里静置30中以上
采集精子
用酒精消毒所有的解剖器具
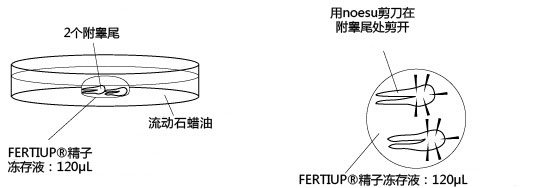
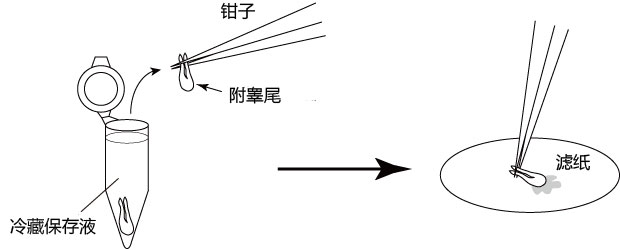
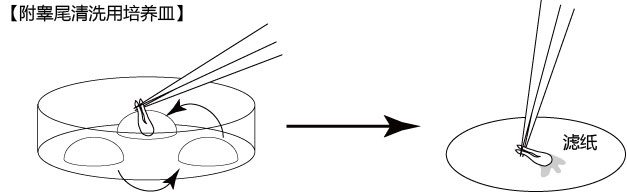
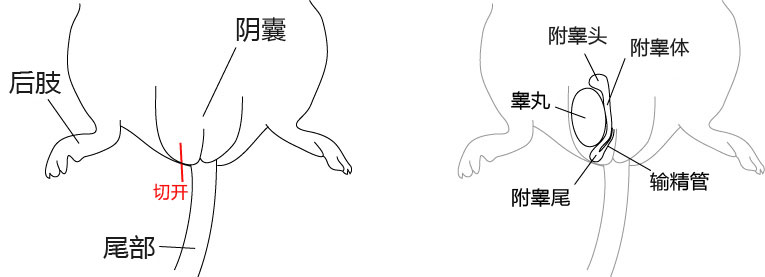
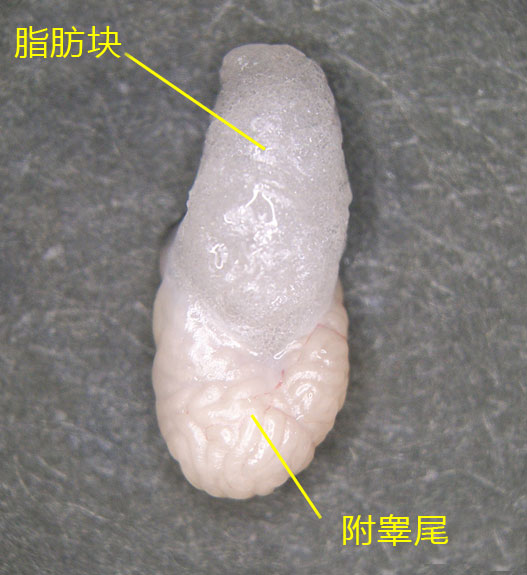
1. 让1~2只成年雄性小鼠(3~6个月龄)安乐死,用大剪刀和大钳子取出附睾管、附睾及一部分脂肪,在滤纸上切除附睾尾及去除血液和脂肪;
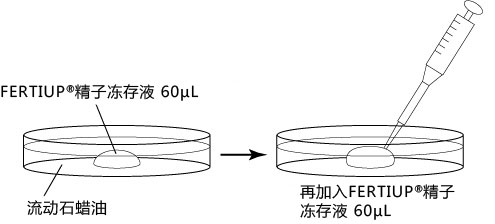
2. 把切除的的附睾尾放入精子预孵用培养皿的流动石蜡中;
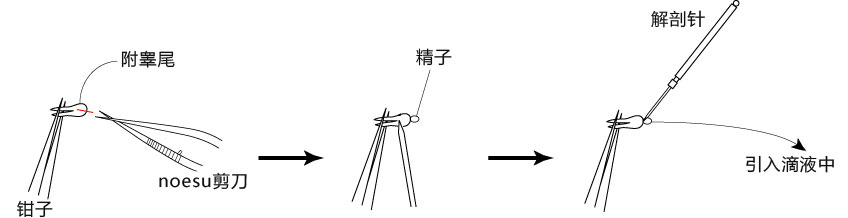
3. 用小镊子固定附睾尾,用noesu剪刀切开尾部中央的附睾管;
4. 用解剖针在附睾尾轻压,从附睾管的切开位挤压出精子块;
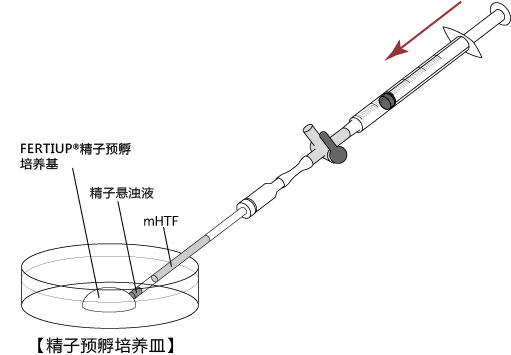
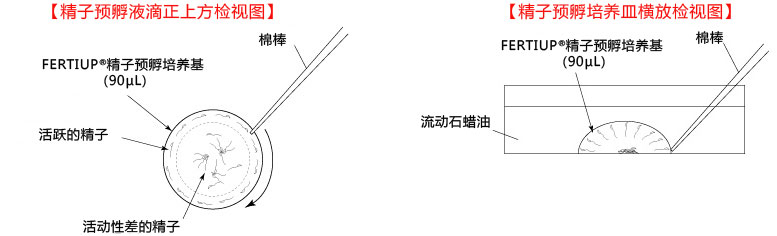
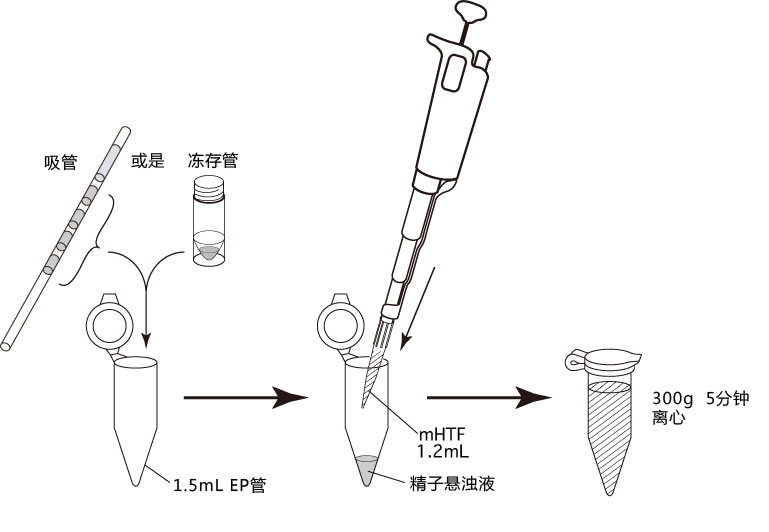
5. 迅速用解剖针挑出精子块,然后放进FERTIUP® 的精子预孵培养基的滴液里;
*在精子预孵培养皿的滴液里,如精子黏在解剖针的尖端,可用另一根解剖针轻柔地把精子剥离;
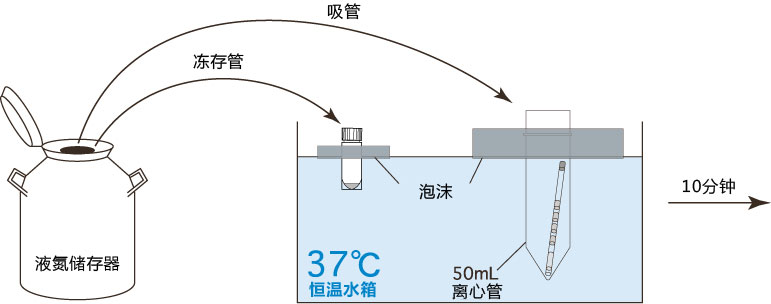
6. 把精子注射入FERTIUP® 精子预孵培养基里,放进CO2培养箱里(37°C 5% 二氧化碳 95% 空气)培养60分钟。
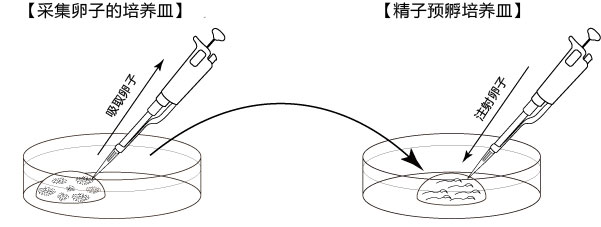
采集卵子
用酒精消毒所有的解剖器具
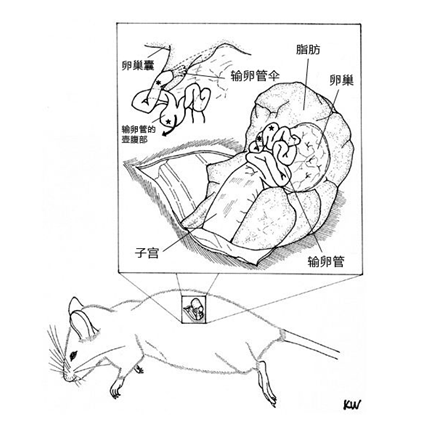
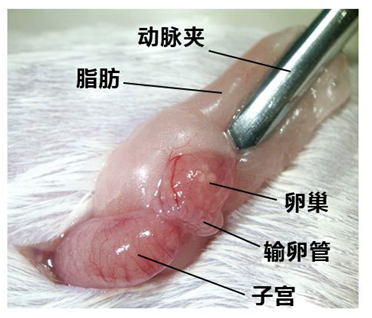
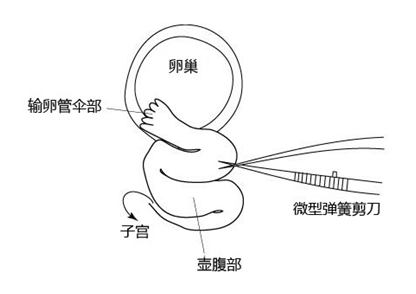
1. 让进行了过量排卵处理的雌性小鼠在注射了hCG的15~17个小时后安乐死,取出小鼠的子宫、输卵管、卵巢、及一部
1. 分脂肪,然后在滤纸上切除输卵管的尾部及 去除血液和脂肪;
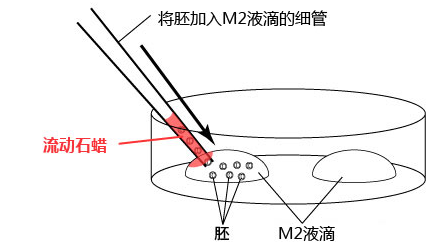
2. 把输卵管浸入受精用培养皿的流动石蜡中;
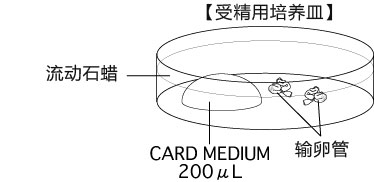
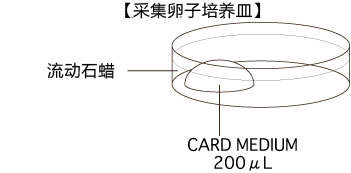
3. 用镊子把输卵管固定到培养皿底部,用解剖针撕破输卵管壁的胀大部分,把流出的卵子放入CARD MEDIUM 的滴液中。
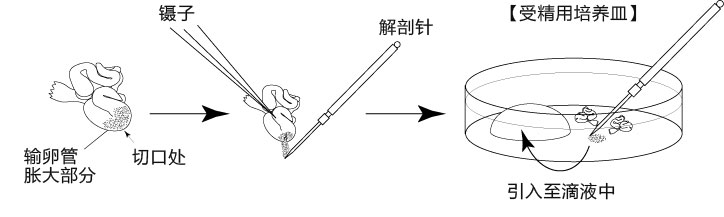
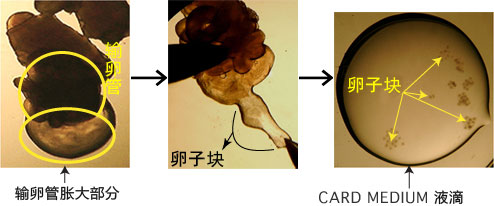
取出的输卵管放置在室温下3分钟以上,卵子的受精能力及生殖能力就会显著下降,因此从雌性小鼠安乐死后到将输卵管取出,再把卵子放入受精用的CARD MEDIUM滴液这一过程要在极短时间内完成(30秒内)。
一个人实验的情况下,请不要一次性安乐死数只雌性小鼠,应该一只只进行,并迅速采集卵子。
一滴CARD MEDIUM里,请引入一只雌性小鼠(两颗)的卵子。
4. 采集卵子后,把受精用培养皿静置在CO2培养箱里进行30~60分钟的培养。
受精
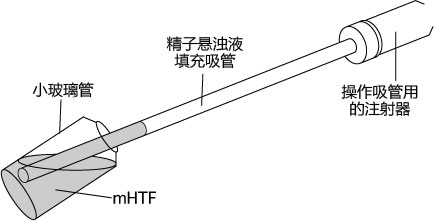
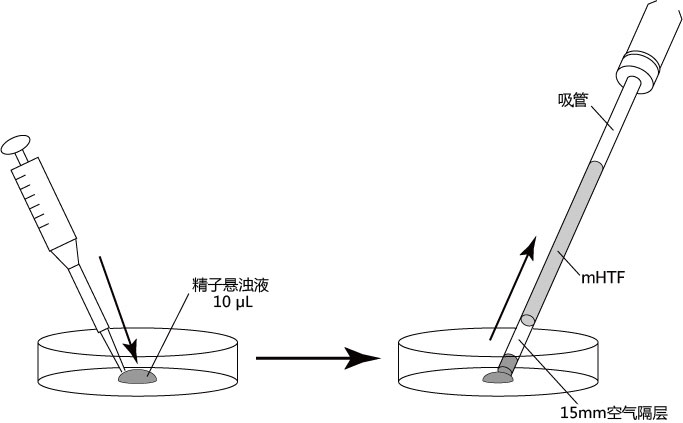
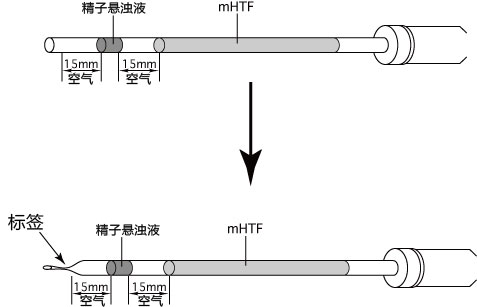
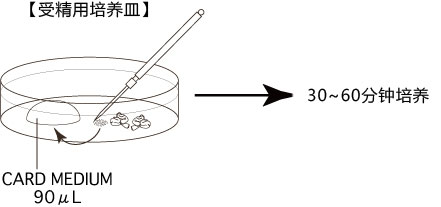
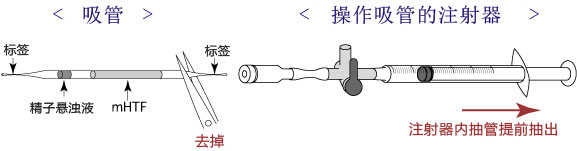
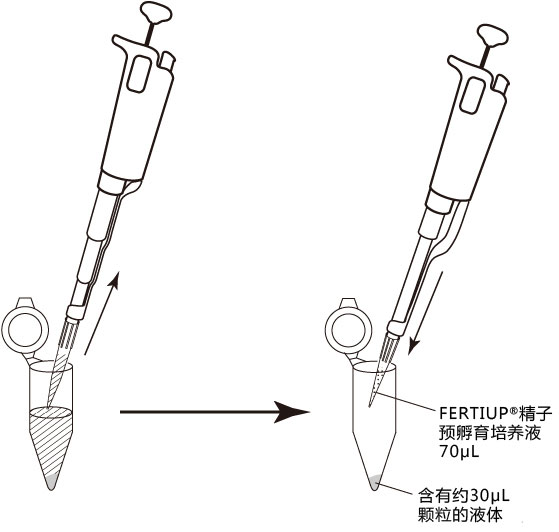
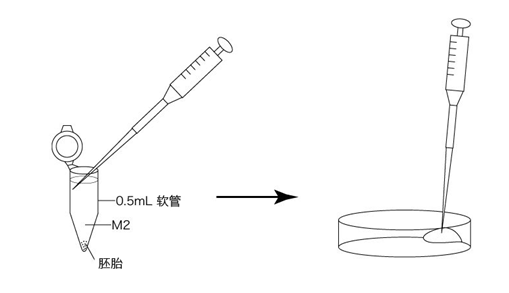
1. 用受精用枪头(Quality Scientific Plastics Pipet Tip Cat.No.114),吸取约6µL预孵的精子悬浊液,然后注射进含有卵子的受精用培养皿的CARD MEDIUM滴液里(进行受精);
2. 将受精用培养皿放在CO2培养箱里进行培养;
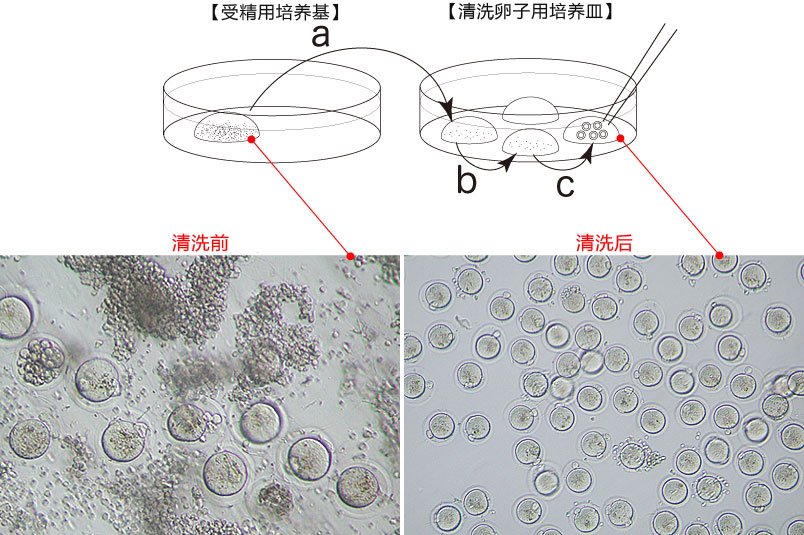
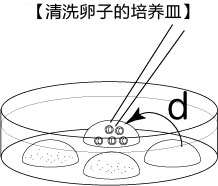
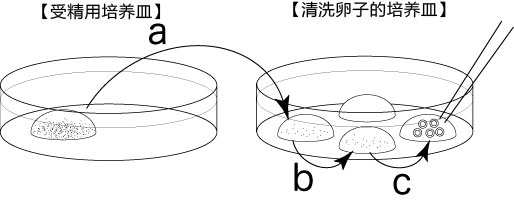
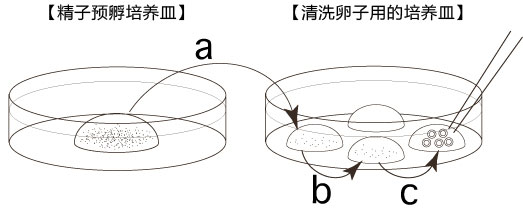
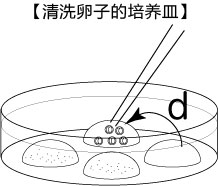
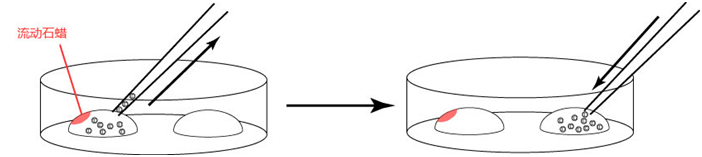
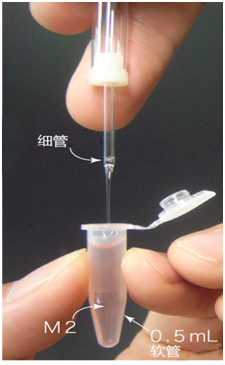
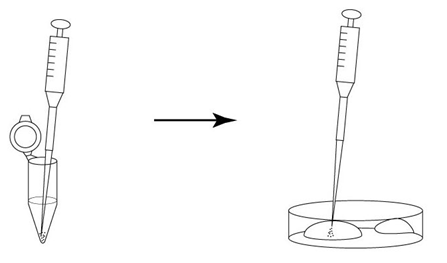
3. 受精3小时后,用玻璃微管吸取形态正常卵子,注射到新的清洗卵子用培养皿的mHTF滴液里,按照(a→b→c)顺序进行洗涤;
* 清洗时,要非常注意在清洗卵子培养皿的滴液上不能混有CARD MEDIUM®
* 清洗前,卵子的透明带表面附着许多精子,使用装有黄色枪头的电动移液器(20μL),在受精用的培养皿的CARD MEDIUM®滴液里移液20~30次后,再清洗卵子。
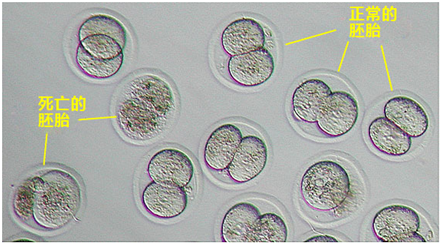
4. 受精6个小时后,仔细观察卵子,去取单性生殖卵(卵子细胞内只有1个原核),培养至次日。
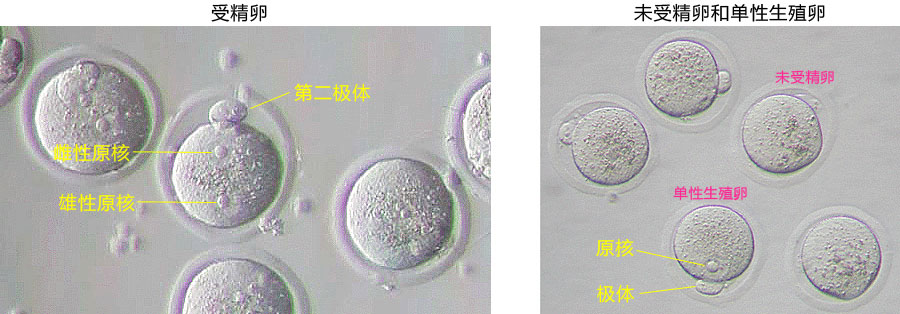
正常受精卵可见第二极体和雌雄原核(见左图),单性生殖卵里只有一个原核(见右图),未受精卵无法看到原核(见右图)
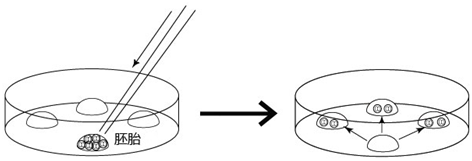
5. 次日(受精24~28小时后),次日,只把发育到2细胞期的胚胎移到清洗卵子用的培养皿内留下的滴液里,数完胚胎数后,就能将其用于移植或者冻存。
2细胞期胚胎直到囊胚期前都能在体外进行培养 ,在培养时要使用KSOM/AA。
参考文献
【1】 Takeo T., Nakagata N. 2015 Superovulation Using the Combined Administration of Inhibin Antiserum
and Equine Chorionic Gonadotropin Increases the Number of Ovulated Oocytes in C57BL/6 Female Mice. PLoS One.
2015 May 29;10(5):e0128330. doi: 10.1371/journal.pone.0128330.
更新说明
更新 2015.06.01
本实验与使用PMS/hCG进行体外受精的相比,有以下两个不同点。
第一点是在受精用培养皿的CARD MEDIUM滴液中放进两颗未受精卵子;第二点是需要6µL受精用的精子悬浊液。
更新 2015.09.03
注射CARD过量排卵诱导剂的小鼠日龄从24~28日改成25~29日。
注射量由0.2mL改成0.1mL~0.2mL。
更新2015.11.18
把CARD过量排卵诱导剂改写成CARD HyperOva™
用C57BL/6J小鼠进行实验时,发现26~30日龄的小鼠实验效果良好,特此更改注射期。





















 →clip applicator
→clip applicator