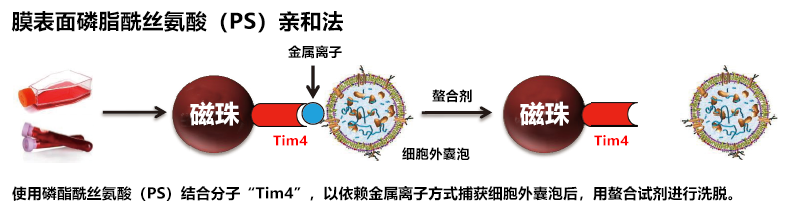
细胞重编程——1. 什么是细胞重编程
细胞重编程是将特定类型细胞转化成其他细胞类型。尤其是直接重编程体细胞,比如成纤维细胞转化成多能细胞,比如诱导性多能干细胞,或者iPS细胞。2006年,干细胞研究领域出现了革命性的发现。逆转录病毒载体过表达小鼠4种转录因子Oct4, Sox2, Klf4, 和 c-Myc (mOSKM),将小鼠胚胎成纤维部分重编程成为诱导性多能干细胞(iPS)(Takahashi 和 Yamanaka 2006). 接下来其他实验室制备了完全重编程的小鼠iPS细胞系,这些细胞实验证实具有小鼠胚胎干细胞(ES 细胞)相当功能,能够形成嵌合小鼠(Wernig et al 2007)。相应的,重编程也可以在人细胞上操作。使用hOSKM转录因子 (Yamanaka 2007) 或者使用一套因子组合(用Nanog和Lin28代替Klf4 和 c-Myc )(Thomson 2007)可以制备iPS。
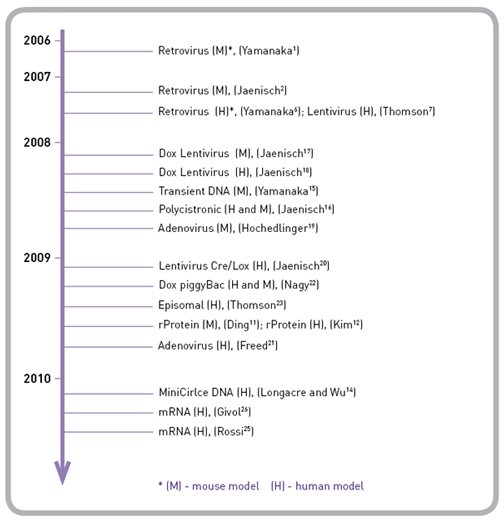
◆重编程的发展历程
重编程技术和递送技术近年来迅速发展,现在已经可以采用多种方法递送和表达必要的重编程因子进行直接重编程。这些方法包括整合逆转录和慢病毒载体,dox诱导表达系统和减少或者去除插入到宿主细胞基因组的瞬时或者可割取的方法。最近突破性的技术是在2010年9月干细胞会议上发布的修饰合成mRNAs,可以高效的进行人成纤维细胞的重编程,基因组不会发生改变。该项学术研究加速了其他策略的发展,会有更多的研究成果。
细胞重编程——指南目录
1. 什么是细胞重编程
2. 细胞重编程概述
3. mRNA重编程
4. 病毒重编程
5. 产品列表
参考文献
[1] Takahashi, K., Yamanaka, S. (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4):663-76.
[2] Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B.E., Jaenisch, R. (2007) In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature, 448(7151):318-24.
[3] Boland, M.J., Hazen, J.L., Nazor, K.L., Rodriguez, A.R., Gifford, W., Martin, G., Kupriyanov, S., Balwin, K.K. (2009) Adult mice generated from induced pluripotent stem cells. Nature, 461(7260): 91-4.
[4] Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. (2009) iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell 5; 135-138.
[5] Zhao, X.Y., Li, W., Lu, Z., Liu, L., Tong, M., Hai, T., Hao, J., Guo, C.L., Ma, Q.W., Wang, L., Zeng, F., Zhou, Q. (2009) iPS cells produce viable mice through tetraploid complementation. Nature 461; 86-90
[6] Takhashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka S. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131(5):861-72.
[7] Yu, J., Vodyanik, M.A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J.L., Tian, S., Nie, J., Jonsdottir, G.A., Ruotti, V., Stewart, R., Slukvin, I.I., Thomson, J.A. (2007) Induced pluripotent stem cell lines derived from human somatic cells. Science, 318(5858):1917-20.
[8] Shi, Y., Desponts, C., Do, J.T., Hahm, H.S., Schöler, H.R., Ding, S. (2008) Induction of pluripotent stem cells from mouse embryonic fibroblasts by Oct4 and Klf4 with small-molecule compounds. Cell Stem Cells, 3(5), 568-574.
[9] Huangfu, D., Osafune, K., Maehr, R., Guo, W., Eijkelenboom, A., Chen, S., Muhlestein, W., Melton, D.A. (2008) Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2. Nature Biotechnology, 26(11):1269-75.
[10] Li, W., Ding, S. (2010) Small molecules that modulate embryonic stem cell fate and somatic cell reprogramming. Trends Pharmacological Science, 31(1):36-45.
[11] Zhou, H., Wu, S., Joo, J.Y., Zhu, S., Han, D.W., Lin, T., Trauger, S., Bien, G., Yao, S., Zhu, Y., Siuzdak, G., Schöler, H.R., Duan, L., Ding, S. (2009) Generation of induced pluripotent stem cells using recombinant proteins. Cell Stem Cell, 4 (5):381-4.
[12] Kim, D., Kim, C.H., Moon, J.I., Chung, Y.G., Chang, M.Y., Han, B.S., Ko, S., Yang, E., Cha, K.Y., Lanza, R., Kim, K.S. (2009). Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell, 4:472-476.
[13] Niwa, H., Miyazaki, J.I., Smith, A.G. (2000) Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nature Genetics, 24:372-376.
[14] Jia, F., Wilson, K.D., Sun, N., Gupta, D.M., Huang, M., Li, Z., Panetta, N.J., Chen, Z.Y., Robbins, R.C., Kay, M.A., Longaker, M.T., Wu, J.C. (2010) A nonviral minicircle vector for deriving human iPS cells. Nature Methods, 7(3):197-9.
[15] Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. (2008) Generation of mouse induced pluripotent stem cells without viral vectors. Science, 322(5903):949–953.
[16] Carey, B.W., Markoulaki, S., Hanna, J., Saha, K., Gao, Q., Mitalipova, M., Jaenisch, R. (2009) Reprogramming of murine and human somatic cells using a single polycistronic vector. PNAS, 106(1):157-62.
[17] Wernig, M., Lengner, C.J., Hanna, J., Lodato, M.A., Steine, E., Foreman, R., Staerk, J., Markoulaki, S., Jaenisch, R. (2008) A drug-inducible transgenic system for direct reprogramming of multiple somatic cell types. Nature Biotechnology, 26(8):916-24.
[18] Hockemeyer, D., Soldner, F., Cook, E.G., Gao, Q., Mitalipova, M., Jaenisch, R. (2008) A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell, 3(3):346-53.
[19] Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G., Hochedlinger, K. (2008) Induced pluripotent stem cells generated without viral integration. Science, 322(5903):945-9.
[20] Soldner, F., Hockemeyer, D., Beard, C., Gao, Q., Bell, G.W., Cook, E.G., Hargus, G., Blak, A., Cooper, O., Mitalipova, M., Isacson,O., Jaenisch, R. (2009) Parkinson’s disease patient-derived induced pluripotent stem cells free of viral reprogramming factors. Cell, 136(5):964-77.
[21] Zhou, W., Freed., C. (2009) Adenoviral Gene Delivery Can Reprogram Human Fibroblasts to Induced Pluripotent Stem Cells. Stem Cells 27(11):2667 – 2674.
[22] Woltjen, K., Michael, I.P., Mohseni, P., Desai, R., Mileikovsky, M., Hämäläinen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein,M., Kaji, K., Sung, H.K., Nagy, A. (2009) PiggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature, 458(7239):766-70.
[23] Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I.I., Thomson, J.A. (2009) Human induced pluripotent stem cells free of vector and transgene sequences. Science, 324(5928):797-801.
[24] Nakagawa M., Koyanagi M., Tanabe K., Takahashi K., Ichisaka T., Aoi T., Okita K., Mochiduki Y., Takizawa N.,Yamanaka S. (2008) Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature Biotechnology, 26(1):101-6.
[25] Warren, L., Manos, P.D., Ahfeldt, T., Loh, Y.H., Li, H., Lau, F., Ebina, W., Mandal, P.K., Smith, Z.D., Meissner, A., Daley, D.Q., Brack, A.S., Collins, J.J., Cowan, C., Schlaeger, T.M., Rossi, D.J. (2010) Highly Efficient Reprogramming to Pluripotency andDirected Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 7:618.
[26] Yakubov, E., Rechavi, G., Rozenblatt, S., Givol, D. (2010) Reprogramming of Human Fibroblasts to Pluripotent Stem Cells using mRNA of Four Transcription Factors. Biochem Biophys Res Commun. 394:189.