内毒素检测——鲎试剂的选择方法
![]()
多项检测(Multi-test):将鲎试剂溶解于内毒素试验用水中,注入一定量到反应试管或多孔板里使用。
单项检测(Single-test):事前把鲎试剂一次测试的分量分注入反应试管。
■试管读数法
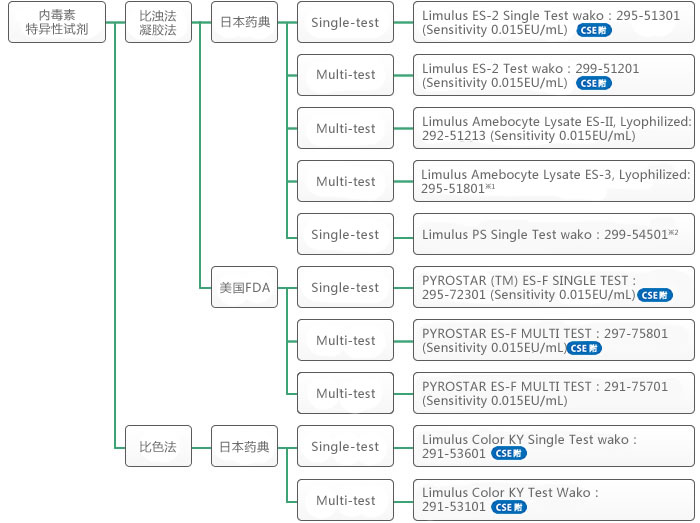
※1:适用于生物制品、浊度法用
※2:适用于不溶于水的样品、浊度法用
■酶标仪法
● 点击查看内毒素检测系列
● 什么是内毒素

![]()
多项检测(Multi-test):将鲎试剂溶解于内毒素试验用水中,注入一定量到反应试管或多孔板里使用。
单项检测(Single-test):事前把鲎试剂一次测试的分量分注入反应试管。
■试管读数法

※1:适用于生物制品、浊度法用
※2:适用于不溶于水的样品、浊度法用

■酶标仪法

● 点击查看内毒素检测系列
● 什么是内毒素
1. 什么是内毒素?
内毒素一种在革兰氏阴性菌细胞壁中发现的脂多糖(LPS)。它是一种典型的热原,哪怕是皮克级(10-12 g)或纳克级的(10-9 g)内毒素进入血液,也会引发各种生物反应。因为其有着耐热性和稳定性,通过高压蒸汽处理也不能完全使内毒素灭活,需在250℃或以上的温度下,干热处理至少半小时才能使其灭活。它存在于革兰氏阴性菌栖息的环境中(例如水,空气),即使在细菌死亡后,细菌性的内毒素(LPS)仍然存在。
图1为脂多糖的结构图,如图所示,脂质A在该物质中是负责生物活性的主要部分,这部分的分子量约为2000。包含糖链部分在内的整个分子的分子量一般为5000到8000左右。然而,因为内毒素是一种同时拥有亲水区(糖链)和疏水区(脂质A)的分子,它能在水溶液中相互缔合,形成表观分子量为数十至数百万的胶束结构。有报告指出,胶束结构的变化,会影响其生物活性的强弱。
图2所示为大肠杆菌型和沙门氏菌型的脂质A的结构。从图中能看出即使菌株不一样,脂质A的基本结构在大体上仍然相同。
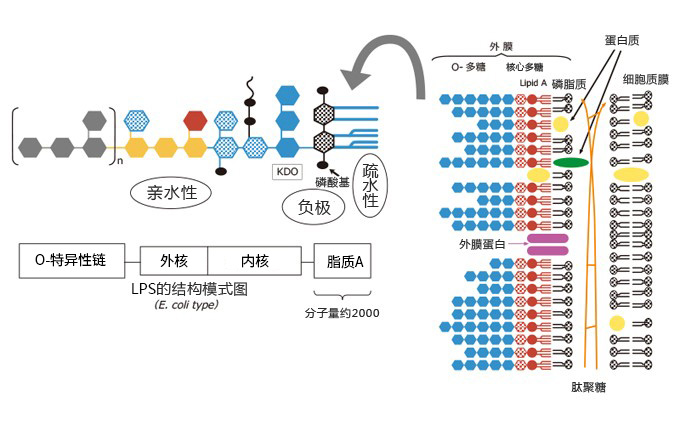
图1. 脂多糖(LPS)结构示意图
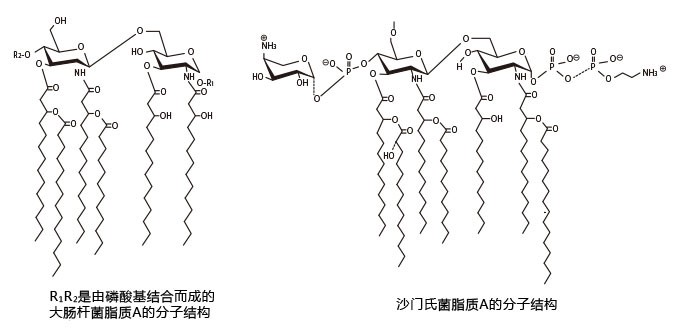
图2. 脂质A的结构(大肠杆菌型和沙门氏菌型)
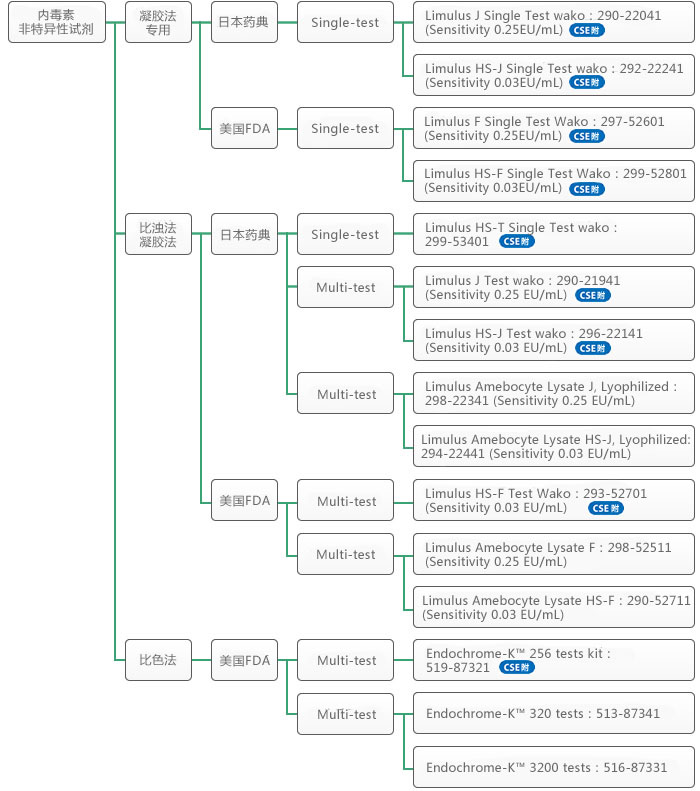
2. 使用鲎阿米巴样细胞溶解物(LAL)试剂的各种内毒素检测方法
由马蹄蟹(美洲鲎)的阿米巴样细胞溶解物制备的试剂可用于检测细菌内毒素。如图3所示,在内毒素的参与下,级联反应开始进行,其中C因子,一种丝氨酸蛋白酶前体,最先被活化。随后接下来的是B因子的活化,B因子也是一种丝氨酸蛋白酶前体和凝固酶前体,它能将凝集原水解成凝集素,形成不溶性凝胶。在LAL测试中,内毒素可以通过三种方式定量:对凝胶的形成进行测定,对浊度的增加进行测定,或对由合成底物分解而释放出的黄色色原体进行测定。
普通的LAL试剂不仅与内毒素反应,而且会与(1→3)-β-D-葡聚糖(真菌细胞壁成分)反应,因为G因子途径会在LAL试剂作用下被激活。为了消除这种(1→3)-β-D-葡聚糖活化,在工业中通过去除G因子或抑制其活化,开发了各种内毒素特异性试剂。
市场上有着各种基于图3中的反应机理所制得的LAL试剂以及检测体系。因此,根据所需的准确度、测试频率、样本数目以及其他相关因素来选择合适的产品是十分重要的。
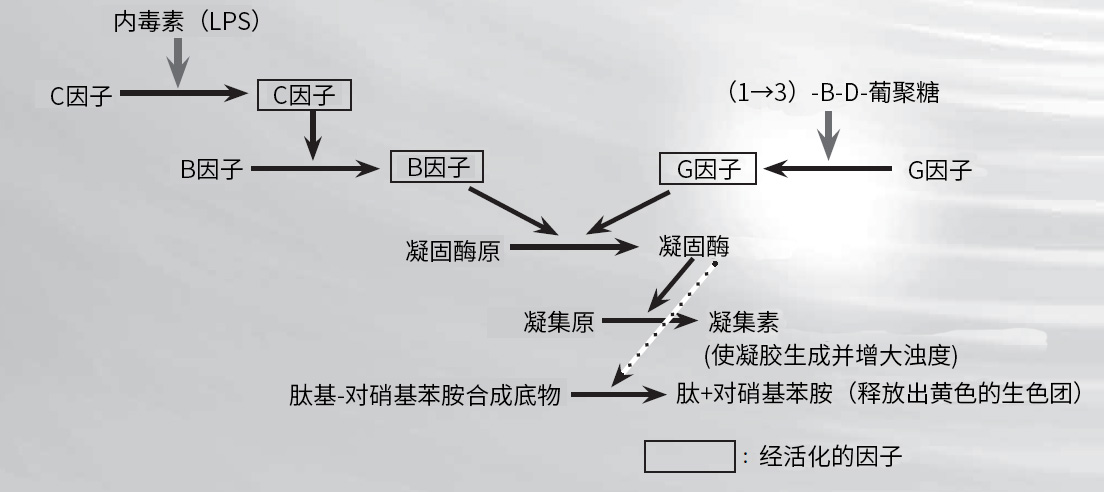
图3. LAL试剂反应机理
美国,欧洲和日本的药典中包含了三种内毒素检测方法,分别是凝胶法、显色法和浊度法,我们会在下面的章节中详述,并且会介绍相关的LAL试剂的特点以及其应用实例。
(1) 凝胶法
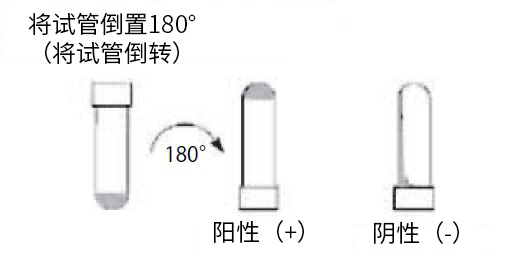
将样本与LAL试剂在试管中混合,并使用干浴器,在37±1°C下,孵育60±2min,期间不要振动。加热完成后,立即缓慢地将试管倾斜180°。如果凝胶已形成并能保持其完整性而不变形或塌陷,则结果可确定为阳性,而如果未形成凝胶则为阴性。在检测期间,对于一系列样本,要进行多倍稀释(通常为2倍),以检查每个样品的结果是否为阳性。确定为阳性的最大有效稀释倍数或最小浓度被称为终点。
相关试剂
在单次型试剂盒和多次型试剂盒中都包含LAL试剂,其中单次型试剂盒中的反应小瓶包含了预分装好的用于单次检测的LAL试剂,而多次型试剂盒则是将所需量的已经溶解好的LAL试剂装入到反应瓶中。单次型试剂盒非常适用于少量样品的检测,而多次型试剂盒则适用于样本量更多的检测。
多次型试剂盒的使用方法式是将0.1mL已经溶解好的LAL试剂分装到反应管中,然后再加入0.1mL样品,并将其混合。而单次型试剂盒的使用方法则是将0.2mL样本加入到含有预先分装好的LAL冻干试剂的反应小瓶中。
ES-II系列
特异性内毒素LAL试剂(不会被(1→3)-β-D-葡聚糖活化),与细菌内毒素检测(BET)(日本药典)相兼容。其胶凝灵敏度为0.015 EU/mL,单次型和多次型试剂盒均有提供。
(2)显色法
由于内毒素会使LAL试剂活化,显色法是根据其对显色底物的分解来检测其活化。由于对硝基苯胺的黄色的吸光度是在405 nm波长下检测的,如果样品在约405 nm波长下具有相当大的光吸收,则不宜使用显色法。
相关试剂
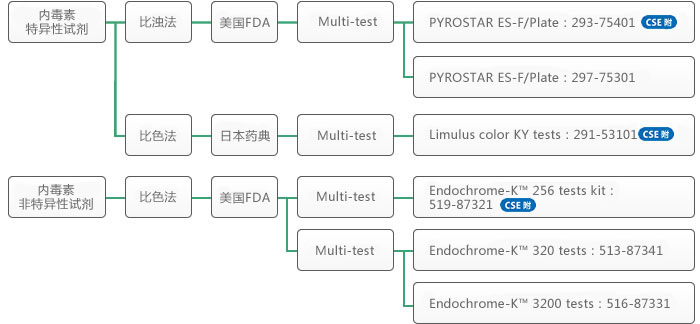
Color KY 系列
内毒素特异性显色法LAL试剂,与BET(日本药典)一致性测试相兼容。与Toxinometer® 结合使用的单次型试剂盒,以及与酶标仪和Toxinometer® 结合使用的多次型试剂盒,可用于动态显色测试。这些系列在我们的试剂产品有着较高的灵敏度:检测限为0.0002 EU/mL(单次型)和0.0005 EU/mL(多次型)。
(3)浊度法
浊度法利用凝胶浊度的变化来检测由内毒素诱导所产生的LAL试剂的活化。它不适用于具有一定浊度的样品。
相关试剂
ES-F系列和ES-II系列
在动态浊度法测量中,可以将ES-F系列、ES-II系列与酶标仪和Toxinometer® 结合使用。这些试剂盒不仅能获得凝胶法的结果,同时能得到动态浊度法的数据,测量时间为60 min。
3.对检测用具的要求
用于内毒素检测的所有检测用具必须不含内毒素和β-葡聚糖。为使内毒素失活,需要在250°C下干热处理超过30 min。建议使用经干热灭菌的玻璃器皿。避免使用金属工具,因为即使有少量被洗脱出的金属离子(例如铁,铝,镓,铬),也可能影响测试。而当使用一次性塑料工具(其制造商未能保证其能用于检测用途)时,检查它们是否满足以下要求(与玻璃器皿相比):1)未被内毒素污染; 2)不吸附内毒素; 3)无洗脱物。
4.内毒素标准品
根据检测目的使用适当类型的内毒素标准品。
•需符合BET(美国药典/ 欧洲药典 / 日本药典)的检测,例如药品和医疗器械的产品最终检验
→必须使用美国药典,欧洲药典或日本药典标准的内毒素国家标准品。
•对材料,工艺流程和其他相关主题的检测
→可以使用内毒素工作标准品(CSE)。
5. 样本干扰
有时候需要采取预防措施,以防止样本对内毒素检测有潜在影响(反应干扰)。这些干扰分为以下两种类型:
(1)对LAL试剂的干扰
•蛋白变性剂(例如酸,碱,尿素,表面活性剂,有机溶剂)
•蛋白酶和蛋白酶抑制剂
•螯合剂(会清除反应所需的钙和镁)
•对于显色法:着色物质(在约405 nm处具有相当大吸收的物质)
•对于浊度法:浊度
(2)对内毒素的干扰
•金属离子(例如铁,铝,镓和铬离子。即使微摩尔级别的存在也会对测试产生影响)
•表面活性剂
样本的干扰效果可以通过进行药典中的干扰因子测试来衡量:即通过对加标了已知量的内毒素的样本进行检测,获得加标内毒素的回收率。如果回收率在50%至200%范围内,则可以确定该样本不会造成影响,换句话说,检测所得的内毒素浓度是正确的。如果发现样本会造成影响,可以通过对样本溶液进行稀释,从而减少对测试的影响。然而,对样本溶液的稀释会提高了由原始溶液(预稀释溶液)的浓度转换而得的内毒素浓度值。合理的稀释倍数(最大有效稀释倍数),是根据待检测的内毒素的所需浓度以及所用LAL试剂的检测灵敏度来确定的。欲了解反应干扰因子和最大有效稀释度的详细信息,详见药典中的细菌内毒素检测。
6. Limulus ES的原理(内毒素特异性试剂)
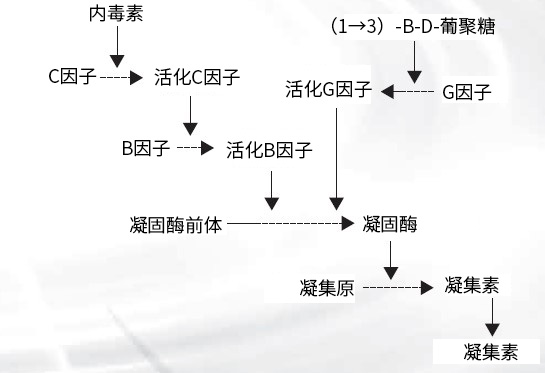
图4. 鲎试验反应级联
LAL试剂和内毒素的级联反应机制如图4所示。如果反应体系中存在(1→3)-β-D-葡聚糖*,会激活G因子,引起伴有凝胶化的假阳性反应。在这种情况下,无论体系中是否存在内毒素,都会发生反应,意味着无法对内毒素进行特异性检测。为此,我们研发出Wako's Limulus ES,该产品通过在反应体系中加入过量共存的(1→3)-β-D-葡聚糖(羧甲基化凝胶多糖),从而来抑制(1→3)-β-D-葡聚糖的干扰。因此,β-葡聚糖对LAL试剂的活化受到抑制,从而使内毒素特异性检测能够进行。过量的β-葡聚糖可以抑制其自身反应的原理如图5所示:β-葡聚糖和LAL试剂之间反应的浓度范围对于整个反应而言很窄。另一方面,内毒素和鲎试剂的反应在很宽的浓度范围内都会发生,并且不受大量共存的β-葡聚糖的任何干扰。Wako的Limulus ES就是根据这个原理而制作的(见图6)。
*(1→3)-β-D-葡聚糖来源于霉菌(真菌)或经纤维素滤膜过滤所得。
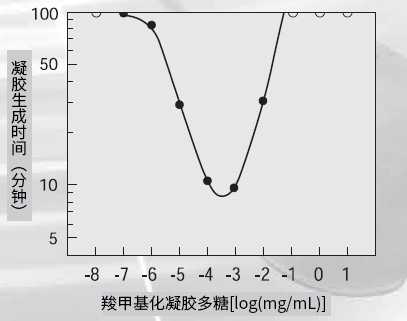
图5. 羧甲基化凝胶多糖和LAL反应
使用Toxinometer®(检测时间设定为99 min)和Limulus HS进行检测。
○在99 min内检测不到凝胶的生成
●有凝胶的生成
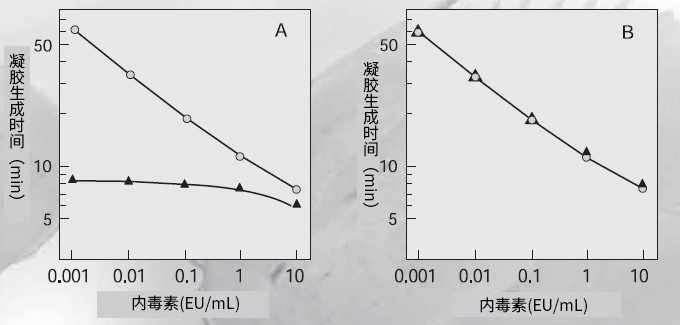
图6. 羧甲基化凝胶多糖对使用Limulus HS和Limulus ES进行的内毒素检测的影响
A:Limulus HS
B:Limulus ES
○内毒素的系列稀释
▲含有1 μg/mL羧甲基化凝胶多糖的内毒素系列稀释
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
295-72301 |
Limulus Amebocyte Lysate PYROSTAR™ ES-F SINGLE TEST SENSITIVITY 0.015 EU/mL (25 LAL) |
for Endotoxin Detection |
25 tests |
|
291-75701 |
Limulus Amebocyte Lysate PYROSTAR™ ES-F MULTI TEST (without CSE) |
for Endotoxin Detection |
100 tests |
|
295-51301 |
Limulus ES- II Single Test wako |
for Endotoxin Detection |
25 tests |
|
299-51201 |
Limulus ES- II Test wako |
for Endotoxin Detection |
60 tests |
|
292-51213 |
Limulus Amebocyte Lysate ES-II,Lyophilized |
for Endotoxin Detection |
2 mL×5 |
|
293-75401 |
Limulus Amebocyte Lysate PYROSTAR™ ES-F/Plate (with CSE) |
for Endotoxin Detection |
160 tests |
|
297-75301 |
Limulus Amebocyte Lysate PYROSTAR™ ES-F/Plate (without CSE) |
for Endotoxin Detection |
200 tests |
|
291-53601 |
Limulus Color KY Single Test wako |
for Endotoxin Detection |
25 tests |
|
291-53101 |
Limulus Color KY Test Wako |
for Endotoxin Detection |
60 tests |
|
290-33771 |
Toxinometer® ET-6000/J Standard Set |
— |
1 set |

内毒素是革兰氏阴性菌细胞壁成分中的一种强效毒素。一旦进入到人的血液中,就会引起发热或致死性休克,因此,我们必须保证药物没有受到内毒素的污染。FUJIFILM Wako研发生产裂解试剂(鲎试剂)和检测仪器“Toxinometer”,不断推动内毒素检测技术的进步,30多年来一直支持药物的发展。
◆从裂解试剂的进口销售到内毒素检测仪器的开发

FUJIFILM Wako位于美国的工厂(地址:弗吉尼亚州里士满)
最初,内毒素检测采用的是兔热源试验。将试剂注射到兔子体内,再根据兔子体温的上升程度判断内毒素的含量。但该试验耗时长,而且使用动物的方法无法保证可靠的结果。
1956年,美国动物学家F.B.Bang发现鲎的血液能使内毒素凝固,他利用鲎的血细胞提取物配制出内毒素检测试剂(鲎试剂,后改名为裂解试剂),随后又利用该试剂开发出了“凝胶法”。凝胶法在1980年被收录到美国药典中,而在此之前FUJIFILM Wako就已经开始进口和销售内毒素检测试剂。但凝胶法只是一种半定量法,其精确度会受检测者操作熟练度的影响。
为解决上述问题,FUJIFILM Wako在1985年通过对传统原理的改进,首次开发出“浊度-时间分析法”和检测仪器“Toxinometer-ET-201”。与此同时,美国ACC公司(Associates of Cape Cod,.INC)利用相同的检测原理,开发出“LAL-5000”检测系统。基于这一情况,浊度-时间分析法在1987年被收录在美国食品药品监督管理局指南中。
FUJIFILM Wako的技术开发仍在继续,1988年开发出面向少量样品用户的“Toxinometer-ET-208”,1994年升级的第二代“Toxinometer-ET-301”集收集检测数据和数据处理、报告输出等功能于一体,深受广大制药商的欢迎。
在2004年发售了第三代“ET-5000”后,目前,FUJIFILM Wako提供支持浊度法、显色法、凝胶法“Toxinometer-ET-7000”和多种试剂。作为内毒素检测的先驱,FUJIFILM Wako一直对药物的安全生产和品质管理做出贡献。
◆竭力推广内毒素检测技术
目前,药典中记录的3种内毒素检测法分别为凝胶法、浊度法和显色法。除此之外还有药典未收录的β-葡聚糖检测、肽聚糖检测(SLP试剂)等多种试验法,每种试验法在操作时都有需要注意的地方。
例如,在内毒素检测试验中需要关注试验用具、试验用水等细节。在以药典为基础的试验中则规定进行预试验和定量检测。内毒素的添加方法和求最大有效稀释率对于新手而言可能会有些困难。另一方面,试剂也有多种变化。需要根据试剂的水溶性或不同的动物血液和培养基适当调整检测方法。虽然FUJIFILM Wako会提供“内毒素试验法”手册,但其他手册中未涵括的试验法则需要在操作中多加注意。
凭借1996年日本药典第13次改版中新收录了浊度法和显色法的契机,FUJIFILM Wako首创开展研讨会。此后,每年开展的研讨会都致力传播内毒素检测相关信息、药典中更正的注意事项以及国际动向等信息。自2008年以来,FUJIFILM Wako开始举行内毒素试验法技术研讨会,专注于实验技术的传播。
◆设立获FDA认可的工厂,开发世界唯一的内毒素特异性试剂
世界上第一瓶裂解试剂是在美国开发的,而最初FUJIFILM Wako销售的裂解试剂也是从美国进口的产品。
随着“Toxinometer”的面世,市场开始扩大,试剂需求逐步提高,FUJIFILM Wako在美国建立起了自己的工厂。除了因为当地有丰富的原料鲎以外,还能通过获得以监管严格著称的FDA认可来保证产品的质量。生产出来的试剂必须获得FDA的认可才能在美国及海外销售。
2003年,FUJIFILM Wako收购了位于圣路易斯的Hemakem公司作为进入美国市场的立足点。然后在里士满建立新工厂,获得FDA认可并开始生产试剂。而且FUJIFILM Wako的产品是世界上唯一获得FDA认可的内毒素特异试剂。
试剂会在试管内预先冻干,还有只需添加试剂即可进行检测的单一型试剂盒。在该领域中,世界上也是只有FUJIFILM Wako的内毒素特异试剂获得了FDA的认可。
30年来,FUJIFILM Wako一直参与检测法的改进与“Toxinometer”的开发,并作为日本内毒素检测先驱的一员,竭力推进药物行业的发展。
更多产品详情请点击:Wako的内毒素检测系统

在内毒素检测发展前期,FUJIFILM Wako就致力于开发内毒素检测方法,在开发顺应时代需求的检测仪器的同时,也全力支持内毒素检测的发展与普及。
【参考文献】
*1:Levin,J. and Bang,F.B. Bull. Johns Hopkins Hosp.,115,265 (1964)
*2:Cooper JF, Levin J, Wagner HN. J Nucl Med 11,310 (1970)
更多产品详情请点击:Wako的内毒素检测系统

◆耗材
进行内毒素检测时必须使用不含内毒素和β-葡聚糖的耗材。需要进行30分钟以上超过250℃的干热来灭活内毒素,所以通常会使用干热灭菌的玻璃器具。洗脱出的微量金属离子(Fe、Al、Ga、Cr等)会影响内毒素检测,因此需要避免使用金属器具。如果生产商无法保证一次性塑料耗材适用于内毒素检测,就需要对比玻璃器具,确认一次性塑料耗材①不受内毒素污染;②不吸附内毒素;③不含影响检测结果的洗脱物。
◆标准品
根据实验目的选择合适的内毒素标准品。
● 依据日本药典进行药物最终产品检验等检测。
※必须使用药典规定的内毒素标准品。
● 进行原料或工艺检查。
对在美国销售的药剂(FDA规定)实施最终检验。
※可使用Control Standard Endotoxin(CSE)。
◆样品的影响
进行内毒素检测时必须注意样品对检测的影响(反应干扰因子)。
① 影响鲎试剂的物质
● 蛋白变性剂(酸、碱、尿素、表面活性剂、有机溶剂)
● 蛋白酶、蛋白酶抑制剂
● 螯合剂(捕获反应所需的Ca和Mg)
● 显色法中的着色剂(405nm附近吸光度较大的物质)
● 浊度法中的浊度
② 影响内毒素的物质
● 金属离子(Fe、Al、Ga、Cr离子等。含量低至μM水平也会对内毒素造成影响)
● 表面活性剂
样品对检测的影响可以通过药典中的反应干扰因子测试来判断,即检测加标已知量内毒素的样品并求取加标内毒素量的回收率。在显色法和浊度法(光学定量法)中,若加标内毒素的回收率为50~200%,则样品对检测没有影响,换句话说,样品对该浓度下的内毒素检测没有影响。对样品进行稀释及检测可减少样品对内毒素检测结果的影响。
然而,稀释样品会提高通过原始溶液换算(预稀释溶液)检测出的内毒素浓度。可稀释率(最大有效稀释率)由需要检测的内毒素浓度以及使用的鲎试剂的检测灵敏度决定(反应干扰因子测试最大有效稀释率的详情请参考日本药典中的内毒素检测法)。
在凝胶法中,用于反应干扰因子测试的样品溶液必须使鲎试剂呈阴性判定。即内毒素的量如果超过了鲎试剂检测灵敏度,则检测无法实行。如果难以获得无内毒素污染的样品,原则上建议使用光学定量法来替代凝胶法。另外还可以将鲎试剂更换成灵敏度较低的试剂来进行检测。
欲了解更多相关产品,请点击:Wako的内毒素检测系统

鲎试剂与内毒素反应产生凝胶,这种方法被称为凝胶法。
另外,以光学变化为指标的光学检测法包括在凝胶化的过程中以浊度变化为指标的浊度法,以通过合成底物的水解作为指标的显色法。
凝胶法:以鲎试剂产生凝胶为指标的检测法
显色法:以合成底物的水解引起显色变化为指标的光学检测法
浊度法:在凝胶的过程中以浊度变化为指标的光学检测法
◆凝胶法
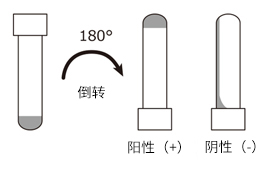
将鲎试剂和样品在试管中混合,并在37±1℃下加热60±2分钟,操作过程中避免摇晃。加热后立即将试管缓慢倒转180°,如果形成不变形不塌陷的凝胶,则结果为阳性,如果未形成凝胶则结果为阴性。等比稀释(通常为2倍)样品,判断在几倍稀释率内结果都为阳性。判定为阳性的最大稀释率(或最小浓度)被称为终点。
对应试剂
■ ES-Ⅱ系列
本系列试剂符合日本药典验证试验的特异性内毒素(不与(1→3)-β-D-葡聚糖反应)检测鲎试剂。胶凝灵敏度为0.015 EU/mL。试剂分为单次型和多次型。
■ ES-F系列
本系列试剂的成分和制法与ES-Ⅱ系列相同,并且已经获得FDA认证,可执行符合FDA的验证试验。是一种特异性内毒素检测鲎试剂。胶凝灵敏度为0.015 EU/mL。试剂分为单次型和多次型。
■ J、F系列
J系列试剂是符合日本药典验证试验的鲎试剂,F系列试剂是符合FDA验证试验的鲎试剂。两种试剂都会与(1→3)-β-D-葡聚糖发生反应。可以根据内毒素浓度选择胶凝灵敏度分别为0.03 EU/mL或0.25 EU/mL的产品。试剂分为单次型和多次型。
◆显色法
显色法通过显色合成底物的分解来检测由内毒素引起的鲎试剂的活化。由于P-硝基苯胺的黄色色度是通过405nm附近的吸光度变化来测量,因此,如果样品在405 nm附近有较大的吸收度,则本方法不适用。
对应试剂
■ Color KY系列
本系列试剂是符合日本药典验证试验的特异性内毒素显色法试剂。
本系列试剂包括能与Toxinometer®(BL2型)组合进行动态-显色法的单次型试剂,以及使用Toxinometer® 或酶标仪进行动态-显色法检测的多次型试剂。
只需使用最低浓度的试剂即可进行高灵敏度检测,这是FUJIFILM Wako产品的一大特点。(单次型试剂的检测限度为0.0002 EU/mL,多次型试剂的检测限度为0.0005 EU/mL)
◆浊度法
浊度法是利用凝胶产生的浊度变化来检测内毒素与鲎试剂反应的方法。本方法不适用于浊度较大的样品。
对应试剂
■ ES-Ⅱ系列
本系列试剂是符合日本药典验证试验的特异性内毒素检测(不与(1→3)-β-D-葡聚糖反应)鲎试剂。试剂分为单次型和多次型。
■ ES-F系列
本系列试剂的成分和制法与ES-Ⅱ系列相同,并且已经获得FDA认证,可执行符合FDA的验证试验。是一种内毒素特异性(不与(1→3)-β-D-葡聚糖反应)鲎试剂。试剂分为单次型和多次型。
■ ES-F/Plate
本试剂符合FDA验证试验,是一种内毒素特异性(不与(1→3)-β-D-葡聚糖反应)浊度法用试剂。
能配合酶标仪进行动态-显色法检测。
■ J、F系列
J系列试剂是符合日本药典验证试验的鲎试剂,F系列试剂是符合FDA验证试验的鲎试剂。两种试剂都会与(1→3)-β-D-葡聚糖发生反应。可以根据内毒素浓度选择胶凝灵敏度分别为0.03 EU/mL或0.25 EU/mL的产品。试剂分为单一型和多类型。
■ HS-T SINGLE
本系列试剂是符合日本药典验证试验的内毒素非特异性(能与(1→3)-β-D-葡聚糖反应)鲎试剂。只有单次型试剂。
欲了解更多相关产品,请点击:Wako的内毒素检测系统
![]()
富士胶片株式会社 生命科学&工程研究所
福地 大树
◆前言
内毒素是存在于革兰氏阴性菌细胞壁外膜的脂多糖(Lipopolysaccharide),进入血液后,只需极少量即可引发出发热症状,大量存在则表现出强毒性,可导致内毒素休克甚至死亡1)。由于革兰氏阴性菌广泛分布于环境中,存在混入生产过程的风险,而混入的内毒素具有耐热性,不易灭活,因此要求注射剂和医疗器械接受严密的内毒素污染管理。近年备受关注的再生医疗、疫苗、抗体和核酸医药相关的产品,内毒素管理对这类产品而言非常重要。
目前检测主流是使用一种利用了马蹄蟹血细胞提取物成分凝血系统的试剂——鲎试剂,来检测内毒素,但为了保护鲎科、稳定供应鲎试剂、减少产品批间差异、提高检测稳定性,各鲎试剂厂家开始促进使用人工原料生产的重组蛋白来研发内毒素检测试剂。
◆内毒素检查法的检测原理
内毒素检查法是使用从马蹄蟹血细胞成分制备得到的裂解试剂进行内毒素检测或定量的方法。马蹄蟹的血细胞提取物成分具有使内毒素凝固的反应体系,这种凝固反应以多个丝氨酸蛋白酶前体依次活化的级联反应为基础(图1)。
内毒素激活马蹄蟹血细胞提取物中含有的C因子,随后活化C因子激活B因子。活化B因子再激活凝血酶原,激活的凝血酶将凝血蛋白原底物水解,并将其转化为凝固蛋白,生成不溶性凝胶。
另外,在马蹄蟹血细胞提取物中,级联反应还会以G因子为起点,与β-葡聚糖发生反应,由β-葡聚糖引起凝血反应(图1)。若想要特异性检测内毒素,需要通过去除G因子或抑制以G因子为起点的级联反应来检测。
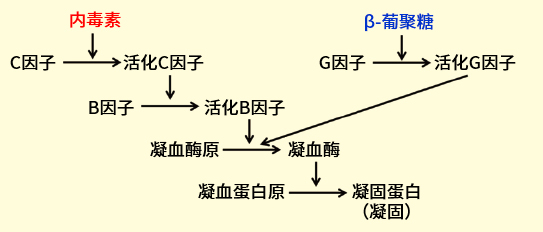
图1. 由内毒素、β-葡聚糖引起的凝血级联反应
◆内毒素的检测方法
内毒素检测大致可分为以下3种:凝胶法(以裂解物试剂的凝胶形成作为指标)、浊度法(检测伴随凝胶化变化的吸光度或透射率来测定浊度变化)、显色法(以合成底物水解产生的显色作为指标)。显色法比凝胶法、浊度法的灵敏度要高。利用重组蛋白的内毒素检测试剂中,除了使用显色合成底物的显色法之外,还有荧光合成底物的检测方法。
◆利用重组蛋白的内毒素检测试剂
目前各公司销售的重组蛋白内毒素检测试剂可分为两种,使用C因子重组蛋白的单因子鲎试剂和使用C因子、B因子、凝血酶原重组蛋白的三因子鲎试剂(图2)。
单因子试剂由于级联反应没有放大,产生的蛋白酶活性小,需要使用荧光底物进行荧光检测。三因子体系试剂与单因子体系试剂相比,酶活性较大,可产生显色反应,因此可以用普通的酶标仪来检测。
另外,近年有报告称,B因子对内毒素的特异性具有重要作用2,3),相比只含有C因子的单因子鲎试剂,含C因子、B因子和凝血酶原三因子鲎试剂更接近于天然鲎试剂。富士胶片和光一直致力于研发三因子重组鲎试剂,目前最新推出的使用重组蛋白的重组鲎试剂(PYROSTAR™ Neo),有着良好的检测性能。

图2. 利用重组蛋白的内毒素检测试剂种类
◆PYROSTAR™ Neo
本次富士胶片和光发售的重组鲎试剂PYROSTAR™ Neo,具有以下的特点:对空白值进行了控制,空白值更低,因此可检测到更低的内毒素浓度(表1)。另外,使用显色法进行检测是裂解试剂的常规分析方法之一,重组鲎试剂PYROSTAR™ Neo检测和分析时可使用能够进行动力学测定的恒温酶标仪和软件进行读数。PYROSTAR™ Neo可以定量0.001 EU/mL~50 EU/mL范围内的内毒素浓度,并能够获得线性良好的标准曲线(相关系数在0.980以上)。
表1. PYROSTAR™ Neo与其他公司产品的比较
|
PYROSTAR™ Neo |
其他公司产品1 |
其他公司产品2 |
其他公司产品3 |
|
|
因子 |
三因子系统 |
单因子系统 |
||
|
定量范围 (EU/mL) |
0.001~50 |
0.005~50 |
0.005~5 |
0.005~50 |
|
检测方法 |
显色法 |
显色法 |
荧光法 |
荧光法 |
◆结语
目前内毒素检测试剂多为以鲎血为原料的裂解液鲎试剂,而使用人工重组蛋白的内毒素检测试剂,其历史较短,并未得到广泛应用。
在此背景下,为推进重组鲎试剂的应用,2021年欧洲药典收录了采用荧光法的重组C因子鲎试剂并作为常规检测方法。在日本药典第十八次修订的最新版本中,收录了《内毒素检测方法与使用重组鲎试剂的替代法》(「エンドトキシン試験法と測定試薬に遺伝子組換えタンパク質を用いる代替法」)作为补充参考信息,但重组鲎试剂并不属于内毒素检查法中规定的“马蹄蟹血细胞提取物成分制备的裂解试剂”。同样,美国药典也将重组鲎试剂视为替代法。据报告,使用替代法时,相比使用裂解试剂的内毒素检查法,需要对这两种方法进行对比研究,确保重组鲎试剂有相同或更高水平的真实性、准确度、灵敏度、特异性等 4)。
今后富士胶片和光将会继续推进重组鲎试剂应用于内毒素检测中的研究,但需满足真实性、准确度、灵敏度、特异性这几点才能满足考虑替代法的制药公司等用户的需求。我们将继续推进鲎试剂的研究,努力实现用户需求、环境和马蹄蟹保护之间的平衡。
◆参考文献
1)棚元憲一:エンドトキシンと医薬品の品質管理,国立医薬品食品衛生研究所報告,126,19(2008).
2)Kobayashi, Y. et al. : J. Biol. Chem., 290, 19379 (2015).
3)Tsuchiya, M. : Int. J. Dev. Res., 10, 36751 (2020).
4)菊池裕 他:医薬品医療機器レギュラトリーサイエンス,48,252(2017).
◆相关产品
内毒素检测重组鲎试剂 PYROSTAR™ Neo
![]()
◆内毒素检测的意义
内毒素在环境中无处不在,主要在细菌裂解过程中由革兰氏阴性菌的外膜释放。若细菌内毒素通过肠胃外途径进入人体,可能会导致发生炎症、感染性休克、出血甚至死亡1。此外,在研究应用中,内毒素污染会导致研究结果不准确并有可能产生误导性的解释。因此,内毒素检测已成为注射药物和医疗器械开发及质量控制的重要组成部分。
◆鲎试剂(LAL)检测,内毒素检测的首选
目前已有多种内毒素检测方法。其中,鲎试剂检测法(LAL)被确立为内毒素检测的金标准试验2,3。LAL检测依赖于从鲎血液中提取的蛋白与样品孵育、反应从而分析内毒素含量。如果所测样品含有内毒素,LAL中的促凝血酶会与其发生相互作用,导致凝血级联反应的激活、变形细胞凝血原的修饰以及凝胶的形成,这被称为凝胶法。对形成的凝胶可进行目视定性评估。虽然凝胶法灵敏且方便,但无法进行内毒素定量检测和高通量分析。因此,人们开始关注定量的LAL检测法。
◆动态鲎试剂检测的发展及优势
动态LAL检测具有显著优势,其可在广泛的浓度范围内定量内毒素含量并实现自动化分析,减少与用户有关的检测差异。内毒素定量可通过浊度(浊度法)或反应混合物的颜色变化(显色法)进行评估。浊度法和显色法均可以动态法或终点检测法的方式进行检测。
浊度法
动态浊度法鲎试剂PYROSTAR™ ES-F
浊度法可评估酶底物裂解后及凝胶形成前发生的浊度(浑浊)形成。使用分光光度计或酶标仪对浊度进行定量。浊度法可靠、灵敏且支持高通量分析。
显色法
动态显色法鲎试剂Limulus Color KY
显色法的原理为鲎试剂使显色底物裂解,从而导致发色团的释放。然后,使用光度计对显色反应进行定量。显色法灵敏度高,可实现自动内毒素测量和高通量分析。
◆基于重组因子的定量分析
重组三因子鲎试剂PYROSTAR™ Neo
除了以上方法,内毒素的定量检测还有重组C因子或多因子的检测法。所使用的重组因子,包含了诱导内毒素的鲎凝血级联反应中的一种或多种蛋白4。
◆变更为动态LAL检测的注意事项
LAL检测已被广泛接受为内毒素检测的标准测试2,3。尽管LAL检测的所有变化都是灵敏、可靠的,但定量LAL检测和基于重组因子C的检测法,由于可提供定量和高通量内毒素的检测而越来越受欢迎。为内毒素检测选择合适的定量分析方法时5,应综合考虑分析样品的性质和特点、可用设备以及可能相关的法规要求等多种因素。
◆文献来源
[1] Sampath VP. Bacterial endotoxin-lipopolysaccharide; structure, function and its role in immunity in vertebrates and invertebrates.
Agriculture and Natural Resources 2018;52:115–120. https://doi.org/10.1016/j.anres.2018.08.002.
[2] Wheeler, A. Comparing endotoxin detection methods. Pharmaceutical Technology 2017;41:58–62.
[3] Mehmood, Y. What Is Limulus amebocyte lysate (LAL) and its applicability in endotoxin quantification of pharma products. Growing
and Handling of Bacterial Cultures. IntechOpen 2019. Doi: 10.5772/intechopen.81331.
[4] Suvarna, K. Endotoxin detection methods – Where are we now?American Pharmaceutical Review. 2015, August 25.
[5] Wong J, Davies N, Jeraj H, Vilar E, Viljoen A, Farrington K. A comparative study of blood endotoxin detection in haemodialysis patients.
Journal of Inflammation (London) 2016;13:24. doi: 10.1186/s12950-016-0132-5.
◆相关产品
内毒素检测系统Toxinometer® ET-7000
PYROSTAR™ ES-F 系列动态浊度法鲎试剂
Limulus Color KY动态显色法鲎试剂
PYROSTAR™ Neo重组鲎试剂
![]()
基因疗法正在彻底改变我们治疗人类疾病的方式。任何通过修改个人基因来治疗或治愈疾病的技术都被认为是基因疗法的形式之一。这些技术可以通过几种潜在的机理实现。一个基因的致病之处可能被灭活,或被健康的版本所取代,又或者是引进一个新的基因来对抗一种疾病。基因治疗产品是通过将遗传物质引入细胞核而发挥作用的。为了引入遗传物质,科学家需要一个可将基因、核酸酶或短发夹RNA(shRNA)运送到人体细胞核的运输系统。携带这种遗传物质的运输工具被称为载体1。
应用于基因治疗的载体多种多样,可分为病毒型和非病毒型。病毒载体是目前美国食品和药物管理局(FDA)批准的基因疗法中使用的载体,而非病毒技术作为一种安全有效地将遗传物质运送给细胞以达到治疗效果的方法正在研究当中1。但与非病毒载体相比,病毒载体的基因转移效率高10倍至1000倍。然而我们应该意识到,基于非病毒载体的基因疗法安全水平高且生产成本低,具有非常高的吸引力,在未来的药物开发中具有很大的潜力5。
目前最常见的两种载体是质粒和病毒。质粒是细胞内的一种小型染色体外DNA分子,与染色体DNA物理分离,可以独立复制。最常以小型环状双链DNA分子的形式出现在细菌中,但有时也会出现在古细菌和真核生物中。在自然界中发现的质粒,往往携带着有利于生物体生存的基因,并能提供独特的优势,例如对抗生素的强烈抗性。染色体很大,并且含有在“正常条件“下生活的全部基本遗传信息,而质粒通常很小,只含有在某些压力、逆境或疾病状态下才可能发挥作用的额外基因2。另一方面,由病毒载体包装的基因可以整合到宿主细胞的基因组中并永久表达。一些类型的病毒可将其基因组插入宿主的细胞质中,但实际上并没有进入细胞,而另一些病毒会伪装成可穿透细胞膜的蛋白分子,进而很容易地进入细胞。可能发生的病毒性感染主要有两种类型,一种被称为裂解性感染,另一种为溶源性感染。裂解循环的病毒在插入其DNA后不久就迅速产生更多的病毒,随后从细胞中迸发出来,继续感染越来越多的细胞。溶源性病毒则是将其DNA整合至宿主细胞的DNA后,在对某个触发因素作出反应前可在体内存活多年。病毒会像细胞一样繁殖,并且不会对所依赖的宿主造成任何伤害,直至被某种方式触发。一旦被触发,病毒就会从宿主的DNA中释放出来,以此创造新的病毒3。
最早应用于基因治疗的病毒载体是以腺病毒为基础的,腺病毒会引起普通感冒以及人类呼吸道、肠道和眼部感染1。腺病毒以双链DNA的形式携带遗传物质。当进入宿主细胞时,这种遗传物质可短暂存在于细胞核中,因此能够像其他基因一样自由进行转录。并且,人们发现腺病毒会在患者体内引发强烈的、具有潜在危险的免疫反应,因此,使用该类型病毒进行基因治疗的研究仍在继续3。逆转录病毒、单纯疱疹病毒等其他病毒载体也已被使用。
基因治疗产品与所有人体治疗药物一样,关键在于不受内毒素污染。内毒素,也被称为脂多糖(lipopolysaccharide)或LPS,是革兰氏阴性细菌外细胞膜的一种成分。作为一种极强的热原,微量接触也会导致危险的发烧甚至败血症。此外,内毒素具有高度的耐热性,很难通过传统的方法来清除。
根据FDA管理指南,所有静脉注射药品的内毒素含量必须低于5 EU每公斤体重。但内毒素普遍存在于环境,实验室也不例外,因此,基因治疗产品在用于人体测试前进行内毒素污染测试是至关重要的。
2019年发表于《Molecular Therapy – Methods & Clinical Development 》的一篇论文测试了一种从重组腺相关病毒(rAAV,一种常见的基因治疗载体)原液中去除内毒素污染的新方法。大肠杆菌通常是内毒素污染的来源,rAAV便是由大肠杆菌中分离出来的质粒DNA制备而来。8
该作者使用LAL(美洲鲎试剂)检测法来定量内毒素水平。清除rAAV原液的挑战之一是任何残留的洗涤剂都会引起毒性,还会干扰LAL检测试剂,从而导致假阴性。其原因在于掩蔽效应,即脂多糖分子被洗涤剂分子包围,无法与LAL试剂相互作用。因此,作者将洗净原液中的洗涤剂水平保持在临界值以下,以便于使用LAL精准地检测内毒素。8
这项研究强调了彻底净化基因治疗产品的重要性,以及为了去除残留的洗涤剂而进行严格的交换缓冲液冲洗的必要性。随着基因治疗的普及,科学家们仍须意识到内毒素污染潜在危险的重要性,以及需要避免由于洗涤剂残留而造成假阴性结果。8
与基于基因疗法的治疗方法一样,细胞治疗产品也需要考虑可能受到污染的问题。细胞治疗产品包括细胞免疫疗法、癌症疫苗和应用于某些治疗适应症的其他类型自体或异体细胞,如造血干细胞和成人及胚胎干细胞。基因治疗是通过蛋白载体或载体将遗传物质转移到合适的细胞中,而细胞治疗是将具有相关和必要功能的细胞转移到患者体内。4,6
在实验室环境中培养任何一种类型的细胞时,所面临的首要问题始终是避免污染。生物污染往往是工作的重点,同时也是最容易检测和避免的。
例如,大多数细菌或真菌污染在细胞培养基中肉眼可见,并可以使用抗生素处理来预防。而支原体或其他细胞系等其他生物污染物则更难检出,但仍可通过市面上的检测试剂盒进行检测。
化学污染与生物污染相比,受到的关注相对较少,并且更难检测和避免。其中,最隐蔽的化学污染物就是内毒素。潜在的内毒素污染源包括水、细胞培养基、血清、玻璃制品和塑料制品。正如本文在基因治疗产品部分中所提及,细胞治疗中发现的内毒素对高压灭菌和辐照都有很强的耐受力,这意味着它们可以在没有活细菌的情况下存在。其高疏水性也使其对塑料制品具有很强的亲和力,而且内毒素与活细菌不同,在细胞培养基无法通过肉眼确认。此外,内毒素不能用抗生素去除,需要使用专门的内毒素清除溶液。
采取措施避免内毒素引起的细胞培养问题,可以使研究人员对实验结果更有信心。为了帮助保持细胞培养物及其产生的疗法不受内毒素的污染,人们已提出了多种解决方法。其中,包括使用高纯度的水和低内毒素的FBS,以及使用经认证为无内毒素的塑料器皿。7 然而,除了使用纯化的原材料和试剂外,建立强大的无菌技术和灭菌程序,对减少内毒素污染的几率而言也非常重要。
无菌技术是每一位生物研究人员必备的核心技能之一。为避免出现实验伪像和潜在的细胞死亡,有必要防止细胞培养物的污染。此外,动物研究中的污染也可能导致感染或死亡。
大多数生物污染物可以使用漂白剂或乙醇等标准的消毒试剂来避免,但内毒素高度稳定,在没有活菌的情况下也能继续存在。因此,对于质控技术人员来说,保持严格的无菌技术标准操作程序至关重要。
定期更换手套是内毒素相关无菌技术的示例之一。没有经验的细胞培养技术员可能认为经常用乙醇喷洒手套就足以保持无菌状态,但乙醇可能会带来内毒素污染,因此,应为使用者制定更换手套的频率标准。
内毒素污染会极大地影响体外实验,特别是涉及免疫细胞的实验。巨噬细胞对内毒素的反应表现为IL-6分泌增加,而T细胞的表现为增殖和淋巴因子的产生增加。
受到内毒素的影响,非免疫细胞也可能会失调。传统上认为内毒素是通过CD14受体起作用的,但缺乏这种受体的细胞仍可对内毒素污染表现出强烈的反应。例如,一项研究报告指出,心肌细胞在暴露于内毒素时,会出现收缩功能障碍。其他研究也报告了CHO细胞内蛋白产生的改变以及输尿管上皮细胞中克隆效率的改变。
此外,不同的细胞系对内毒素污染的灵敏程度差异巨大。一些细胞系在内毒素低于1 ng/mL的情况下即表现失调,而其他细胞系则需要高达5000 ng/mL的浓度。也有理论认为,在培养中生长多年的细胞系(如HeLa和CHO细胞)可能随着时间的推移被自然选择为耐内毒素。基于这一点,很难确定一个广泛适用的内毒素污染安全阈值。
进行细胞培养时,购买低含量内毒素产品是至关重要的。然而,内毒素污染可能在打开试剂后产生,或在玻璃器皿/塑料器皿中转移污染,因此定期进行内毒素检测显得十分重要。
对于基因治疗和细胞治疗产品来说,鲎试剂(LAL)检测法为量化内毒素水平提供了一个兼具成本效益和高灵敏度的选择。本检测法依赖于从鲎血液中提取的蛋白,这些蛋白在内毒素存在的情况下发生凝结反应,可以对其定量以获取高度准确的内毒素水平读数。在维护我们的基因和细胞治疗的安全性方面,特别是应用于大规模生产以及重要的体外实验时,这种检测方法将会继续发挥关键作用。
◆相关产品
点击此处查看相关产品:内毒素检测系统Toxinometer® ET-7000
点击此处查看相关产品:PYROSTAR™ ES-F 系列鲎试剂
◆参考文献
|
1. |
‘How Does Gene Therapy Work?’ (2020 June). Genehome. Available at URL: https://www. thegenehome.com/how-does-gene-therapywork/vectors?gclid=Cj߿KCQjwkZiFBhD9ARIsA GxFX8C53pUEumd-W82HmYSL_5gBGNPtMMD rR_882PILGN_0n9vF8icjPboaAjA-EALw_wcB
|
|
2. |
‘Plasmid’. (2021 May 6). Wikipedia. Available at https://en.wikipedia.org/wiki/Plasmid
|
|
3. |
‘Vectors in Gene Therapy’. (2020 December 16). Wikipedia. Available at URL: https:// en.wikipedia.org/wiki/Vectors_in_gene_ therapy |
|
4. |
‘Cellular and Gene Therapy Products’. (2021 March 2). U.S. Food and Drug Administration. Available at URL:https://www.fda.gov/vaccines-blood-biologics/cellular-genetherapy-products#:~:text=Cellular%20therapy%20products%20include%20cellular,adult%20and%20embryonic%20 stem%20cells |
|
5. |
Lundstrom, K. (2019). “Gene Therapy Today and Tomorrow”. National Center for Biotechnology Information, ‘Diseases’. Published online 2019 April 28. Available at URL: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC6631424/ |
|
6. |
David, A., Professor. “How Cell Therapy differs from Gene Therapy”. Future Learn. Available at URL: https://www.futurelearn. com/info/courses/making-babies/0/ steps/23934#:~:text=Whereas%20gene%20 therapy%20involves%20the,appropriate%20 cells%20of%20the%20body.
|
|
7. |
Easthope, E. (2020). “Five Easy Ways to Keep Your Cell Cultures Endotoxin-Free”. Biocompare, published online 2020 April 20. Available at URL: https://www.biocompare. com/Bench-Tips/563017-Five-Easy-Ways-toKeep-Your-Cell-Cultures-Endotoxin-Free/ |
|
8. |
‘Removal of Endotoxin from rAAV Samples Using a Simple Detergent-Based Protocol’. (2019 December 13). Molecular TherapyMethods & Clinical Development, published online 2019 September 6. Available at URL: https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC6804492/ |
Lisa Komski
Lisa Komski是FUJIFILM Wako Chemicals U.S.A. Corporation LAL部门的销售总经理。在化学和生命科学行业拥有近30年的职业生涯,是美国食品和药物管理局(FDA)要求和cGMP方面的业务发展专业人士。Lisa拥有生物学和医学技术学位。
Email:lisa.komski@fujifilm.com
※ 本页面产品仅供研究用,研究以外不可使用。

注射类药物产品的内毒素污染可导致严重后果,包括发烧、败血症和败血性休克。因此,内毒素检测已成为注射类处方药、医疗器械生产和质量控制的必要检测。
鲎试剂(LAL) 检测是内毒素评估的最佳成熟检测方式1)。其主要采用鲎的变形细胞提取物与待检测内毒素污染样品进行孵育,如果分析样品中存在内毒素,则会形成凝块。最传统的LAL检测方法是定性的凝胶法。随后,开发了定量LAL检测方法,包括显色法和浊度法。
LAL检测的准确性和可靠性已得到证实。然而,被测产品、检测剂成分、环境甚至容器相关的各种因素可能会导致测试难以进行或出现误导性结果,其中包括样品干扰或内毒素掩蔽剂2-4)。可能干扰LAL检测的因素包括化学抑制剂(如乙二胺四乙酸,EDTA);变性剂(如浓酸、碱、无机盐或有机溶剂);碱化乙醇分子;超出最佳范围的pH值;内毒素掩蔽剂(赋形剂、表面活性剂、螯合剂或 N-二甲基氧化胺等物质);或内毒素被容器表面吸收1)。对于医疗器械,抗凝涂层、重金属含量或微粒的存在可能会干扰测试结果2)。对于使用显色法检测的样品,与 鲎试剂接触时,检测混合物中的特定颜色也会干扰测试结果1)。对于用浊度法检测的样品,样品中的浑浊或悬浮也可能导致干扰1)。
以下整理了内毒素检测中不同的抗干扰方法,以降低样品干扰或内毒素掩蔽的因素给实验结果带来的影响:
◆适当稀释样品
如果在LAL检测过程中没有干扰或增强效应,可以对未稀释的样品进行检测。如果样品存在干扰LAL检测的成分,则应稀释样品以减少干扰或增强。建议确定最大稀释倍数,保证减少干扰效应但仍可进行内毒素测定2)。
◆消化、使用缓冲液、过滤或离心
这些都是降低医疗设备检测干扰的潜在处理方法2)。具体选用哪种操作应取决于对实验干扰因素的评估和对检测条件的验证。
◆保持最佳pH范围
LAL检测的最佳 pH 范围在6.0–8.0范围内,检测条件应保持在此范围内以确保结果一致。
◆保证样品的均匀性
悬浮样品可能会导致干扰问题。因此,应尽量保证样品的均匀性。在这种情况下,不建议混合来自制造过程不同阶段的样品,因为难以确保不同阶段产品可以混合均匀2)。
◆调整混合样本的最大有效稀释倍数(MVD)
某些情况下,小体积单位的成品药可能会合并成复合样品,再进行LAL检测。在这种情况下,应通过将单个样品计算的的MVD除以合并样本的总数,按比例将MVD调整为较低值2)。
◆使用在LAL 检测经过充分验证的试剂和样品容器
由于鲎试剂和样品容器的成分也可能对检测结果产生负面影响4),因此建议使用经充分验证的鲎检测和样品容器。
◆相关产品
内毒素特异性鲎试剂PYROSTAR™ ES-F 系列(凝胶法/动态浊度法)
内毒素特异性鲎试剂Limulus Color KY(动态显色法)
◆参考文献
1) Wheeler, A. Comparing endotoxin detection methods. Pharmaceutical Technology 2017;41:58–62.
2) FDA. Guidance for industry: pyrogen and endotoxins testing: questions and answers. June 2012.
3) Reich J, Lang P, Grallert H, Motschmann H. Masking of endotoxin in surfactant samples: Effects on Limulus-based detection systems.
Biologicals. 2016;44(5):417-22. doi: 10.1016/j.biologicals.2016.04.012.
4) Bech Ørving R, Carpenter B, Roth S, Reich J, Kallipolitis B, Sonne-Hansen J. Bacterial Endotoxin Testing-Fast Endotoxin Masking Kinetics
in the Presence of Lauryldimethylamine Oxide. Microorganisms. 2020;8(11):1728. doi: 10.3390/microorganisms8111728.