DNA & siRNA转染试剂
ScreenFect™ A plus
- 产品特性
- 相关资料
- Q&A
- 参考文献
ScreenFect™ A plus
|
|

DNA & siRNA转染试剂
ScreenFect™ A plus
ScreenFect™ A plus
|
|
日本Wako全新推出的DNA & siRNA转染试剂,适用于敏感细胞和各种难转染细胞。
◆原理
ScreenFect™A+是通过点击化学(Click Chemistry)方法筛选出的阳离子脂质体转染试剂。适用于各种真核细胞,也可直接添加到含有抗生素或者血清的培养基中。使用ScreenFect™A+转染试剂可将DNA和siRNA转入常见实验室培养的细胞株(HeLa、HepG2、MDCK等)、干细胞(小鼠ES细胞等),血液细胞(巨噬细胞、THP-1、RAW264等),小胶质细胞和原代细胞。由于低细胞毒性,不含有任何有毒有害成分,转染后无需更换培养基。
※1 Biomaterials. 2012 Nov; 33(32):8160-6. 2012
◆特色
● DNA用量少。
● 高效一步转染法。
● 转染效率高&细胞毒性低。
● 使用成本低
更多产品详情请点击此处
试用申请请点击此处
通过敲降CDK8/19表达诱导Foxp3
![]()
为了抑制有害免疫反应(例如自身免疫性疾病和变态反应),其中一种方法是将介导疾病的T细胞转化为免疫抑制性调节性T细胞(Treg)。在这里,我们显示对细胞周期蛋白依赖性激酶8(CDK8)和CDK19的化学抑制,或CDK8或CDK19基因的敲降/敲降,能够在抗原刺激下诱导Foxp3(控制Treg细胞功能的关键转录因子)效应子/记忆以及未成熟的CD4+ 和CD8+ T细胞。诱导与STAT5激活相关,独立于TGF-β的作用,不受炎症细胞因子的影响。结果表明,CDK8/19在生理上抑制活化的常规T细胞中的Foxp3表达,并且其药理抑制作用使得抗原特异性效应子/记忆T细胞能够转化为Foxp3+Treg细胞,有望用于治疗各种免疫疾病。
传统的脂质体转染方法和电穿孔转染方法不能有效地对免疫细胞进行转染,本研究采用了日本石原产业的GenomONE® 仙台病毒包膜转染技术,通过将siRNA包装到仙台病毒包膜(HVJ-E)中,与靶细胞接触后,通过F蛋白介导膜融合,将siRNA导入到T细胞内部,轻松实现免疫细胞的高效表达敲降。
数据提供:大阪大学 免疫学前沿研究中心 实验免疫学领域 三上统久 老师
相关文献:Sci. Immunol, 4, eaaw2707 (2019).
◆结果
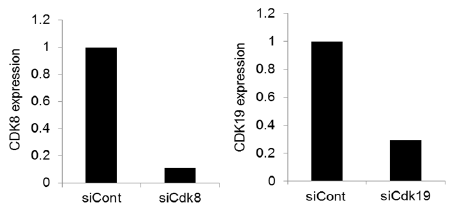
图1 小鼠T细胞中CDK8、CDK19的敲降
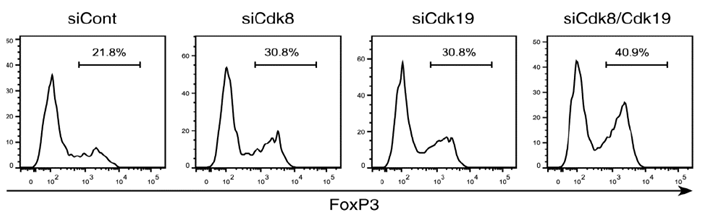

图2 CDK8/19敲降后Foxp3的表达
通过使用GenomONE–Si 进行转染,抑制了小鼠T细胞中CDK8、CDK19的基因表达(图1)。另外,在敲降了CDK8/19的状态下进行Treg诱导实验的结果表明,抑制CDK8/19的表达能够促进Treg的分化(图2)。
◆结论
在不使用重组病毒的情况下,通过GenomONE–Si成功将小鼠原代T细胞导入了siRNA。
◆实验方法
1. 表达Foxp3-GFP报告基因的小鼠的淋巴结中分离T细胞;
2. 使用GenomONE-Si转染分离细胞中的CDK8或CDK19的特异性siRNA(250 nM);
3. 存在IL-2(50 U/mL)、TGF-β(2 ng/mL)的情况下使用小鼠T细胞激活磁珠刺激T细胞
3. (2×104/well : 96 well plate);
4. 培养24 h后,按照步骤2. 再次转染siRNA;
5. 步骤4. 培养48 h后,通过流式细胞仪以及实时PCR检测CD4阳性细胞中的Foxp3阳性细胞、CDK8/19 mRNA表达量。
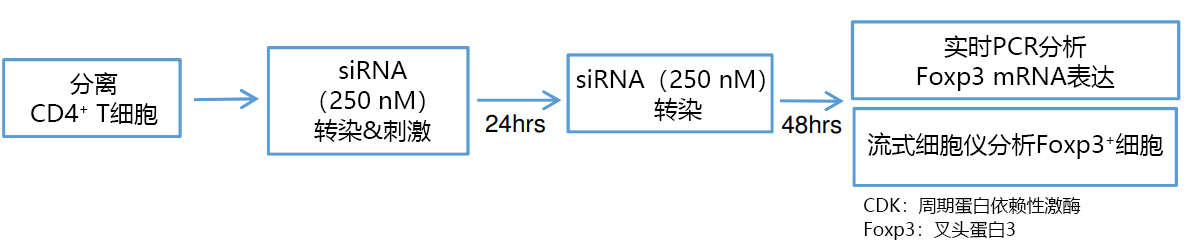
◆HVJ-E载体的制备方法
按照GenomONE–Si 使用说明书操作方案(1)进行
【细胞】:Foxp3-GFP报告小鼠的淋巴结中分离的T细胞
【培养条件】:2×104 cells/well/100 μL,RPMI-1640,10% FBS,penicillin G (60 μg/mL),
【培养条件】:streptomycin (100 μg/mL),0.1 mM 2-ME
【培养板】:96 well 培养板
【siRNA】:CDK8 siRNA,CDK19 siRNA,Negative control siRNA (Thermo Fisher Scientific )
【转染】:GenomONE–Si(石原产业)
|
步骤 |
流程 |
试剂量 |
|
① |
使用微型试管提取HVJ-E悬浮液中 |
HVJ-E悬浮液:2.5 μL |
|
② |
添加·混合Reagent D(轻敲混匀) |
Reagent D:0.5 μL |
|
③ |
添加·混合siRNA溶液(轻敲混匀)(50 μM) |
siRNA溶液:10 μL |
|
④ |
添加·混合Reagent E(轻敲混匀) |
Reagent E:5 μL |
|
⑤ |
将步骤④中制备的HVJ-E载体悬浮液添加到孔中的细胞培养液中, 在37°C、5% CO2下培养。 |
HVJ-E载体悬浮液(①+②+③+④): 2 μL/well |
在冰上进行①~④的操作。
CDK8/CDK19 siRNA转染时,按照上述操作方案分别制备siRNA,并以2 μL/well(总计:4 μL/well)加入至孔中。
◆产品列表
|
产品编号 |
产品名称 |
包装 |
|
380-18764 |
GenomONE®-Si |
16 sets/pack |
|
382-18763 |
GenomONE®-Si |
4 sets/pack |
|
386-18761 |
GenomONE®-Si |
1 set/pack |
|
386-18766 |
GenomONE®-Si |
40 sets/pack |

高性能基因导入试剂
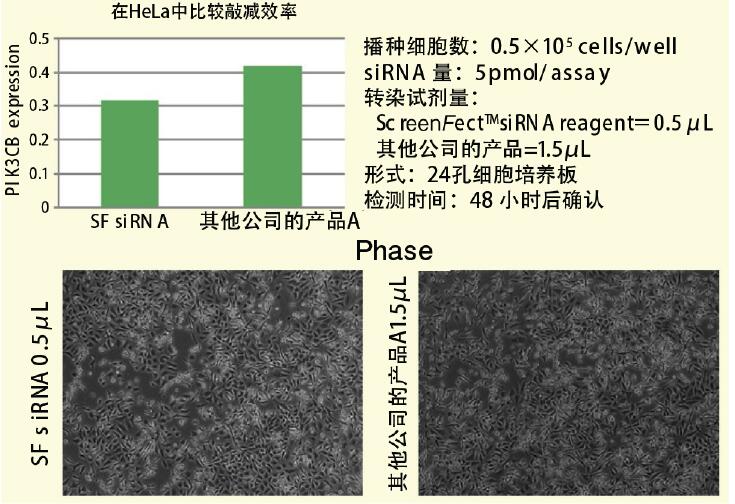
下面为大家介绍使用 ScreenFect ™ siRNA 向 HeLa 细胞导入 siRNA 数据的实验成果及逆转染(1-STEP)Protocol。
◆向 HeLa 细胞的逆转染例子(24孔培养板)
细胞的前期培养
1. 用适当的培养容器(T-75 烧瓶),将 HeLa 细胞培养至半融合状态。
配制转染试剂
1. 准备两支 1.5 mL 灭菌试管。
2. 在其中一支试管里加入 24.5 μL ScreenFect ™ Dilution buffer。
3. 再往步骤2的试管里加入 0.5 μL 的 ScreenFect ™ siRNA reagent,使全部容量达到 25 μL。…溶液(A)
(ScreenFect ™ siRNA reagent在使用前进行涡旋处理。)
4. 在另一支试管里加入 24 μL ScreenFect ™ Dilution buffer。
5. 再向步骤4的试管里加入 1 μL 的 5 μmol/L PIK3CB siRNA 溶液(5 pmol)…溶液(B)
6. 将溶液(B)全部添加至溶液(A)的试管中。
7. 轻敲试管,使溶液混合均匀。再用台式离心机降速处理。
8. 在室温下孵浴 5~20 分钟。
配制配制细胞悬浮液
1. 从恒温箱里取出【细胞的前期培养】的烧瓶。
2. 去除培养基,用 PBS 清洗一次。
3. 向烧瓶里添加 2 mL 胰蛋白酶溶液后,放入室温、5% CO2 的恒温箱里培养,直到细胞从培养容器中脱落。
4. 加入约 5 mL FBS 添加培养基使反应停止。
5. 利用移液器使细胞分散,将全部培养液转移到离心管中。
6. 150×g 离心,5 分钟。
7. 去除上清时不要去掉颗粒物。
8. 添加 5~10 mL 新的培养基,利用移液器使细胞分散。
9. 用血细胞计数板等的细胞计算器检测细胞数。
10. 检测出细胞悬浮液的浓度后经过计算,以此配制 2.0×105 cells/mL 的细胞悬浮液(配制的细胞悬浮液量可根据实验规模进行适当地调节。)
转染
1. 将 500 μL 在【配制细胞悬浮液】时配制好的细胞悬浮液添加至细胞培养板里。
2. 将 50 μL 在【配制转染试剂】步骤8中孵浴的 DNA-lipid complex 添加至细胞培养板里,轻摇培养板使溶液混合(也可以先往细胞培养板里加
入 50 μL DNA-lipid complex,再加入 500 μL 细胞悬浮液)。
3. 放入 CO2 的恒温箱里培养 24~48 小时后即可进行后续实验。
◆实验数据
用逆向转染法和正向转染法向 HeLa 细胞进行 PIK3CB siRNA 的导入实验,通过实时定量 PCR 检测出 PIK3CB mRNA 的表达量。将定量结果得出的敲减效率,与原来用其他公司的产品进行实验得出的敲减效率进行比较,结果显示,ScreenFect ™ siRNA 拥有高于其他公司产品抑制目的基因表达的效率。
【逆向转染(1-STEP)】
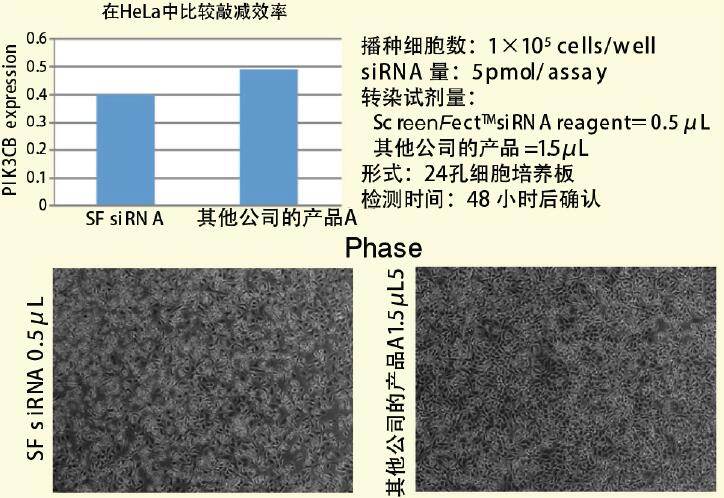
【正向转染(2-STEP)】
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
299-75001 |
ScreenFect ™ siRNA转染试剂 ScreenFect ™ siRNA |
基因研究用 |
0.2 mL |
|
295-75003 |
1 mL |
||
|
293-75004 |
1 mL×5 |
AteloGene® siRNA活体转染试剂盒
AteloGene® Quick Gelation
AteloGene® siRNA 活体转染试剂盒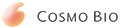
AteloGene® Quick Gelation
◆原理
AteloGene® 的主要成分是 Atelocollagen(去端肽胶原),将合成的 siRNA/miRNA 通过适当混合,形成 siRNA/miRNA 的 Atelocollagen 复合体,该复合物可有效导入细胞,因此适用于活体内转染。
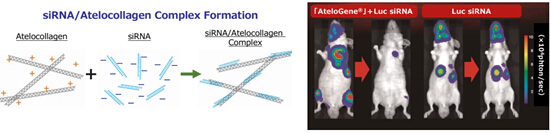
◆制备
siRNA/Atelogene 复合物的制备极其简单:取等体积的 AteloGene® 与 siRNA/miRNA 溶液混合后,注射到小鼠即可。
*siRNA/miRNA 溶液体积:局部 5-10 μM,全身 20-40 μM siRNA
siRNA被高效导入组织
Atelocollagen 和 25 μg 的 siRNA 混合后,通过尾静脉注射,24小时后,可在不同组织中检测到 RNA 的存在。
操作步骤
AteloGene™ 和合成的小 RNA 即混即用:
● 专门用于 siRNA/miRNA 体内转染
● 保护 小RNA 不被RNase降解,延长作用时间
● “AteloGene™”无毒性,其组成成分去端肽胶原具有高生物相容性
● 使用 “AteloGene™ Local Use”,局部给药,给药后,会在体内形成局部凝胶,保持 siRNA停留在给药部位。
● 使用“AteloGene™ Systemic Use”,通过尾静脉注射,全身给药。 给药后,不会在体内形成凝胶,尾静脉注射,通过血液循环,siRNA
被有效的输送到全身。
◆案例、应用
【转染人 RGM249 基因的3种小分子 RNA 后肿瘤明显减小】
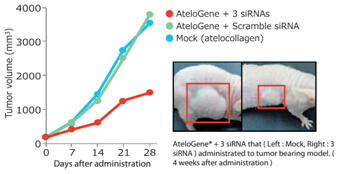
从人 RGM249 基因的小分子 RNA 中,选择三种 siRNAs 和 AteloGene® Local Use 试剂混合,注射到人恶性黑色素瘤皮下肿瘤模型鼠中。
4周后观察到,注射 siRNA 和 AteloGene® 混合物的模型鼠其皮下肿瘤扩散明显减少。
【已报道的 AteloGene® 系列转染案例】
◆产品列表
| 产品编号 | 产品名称 | 规格 | 应用 |
| KOU-1392 | AteloGene® Local Use | 1 Kit | 局部注射后,复合物变为凝胶状,保留在注射部位 |
| KOU-1393 | AteloGene® Systemic Use | 1 Kit | 静脉注射后,随着血液循环可将 siRNA/miRNA传递到全身 |
*标准操作中,每小鼠最大注射剂量为 200 μL;客户可根据实际注射部位调整使用量 10~200 μL。
*以最大剂量计,每 Kit 至少可注射12次
常见问题
Q1: Atelocollagen(去端肽胶原)与普通天然胶原的区别
A1: Atelocollagen(去端肽胶原)是一种通过蛋白酶溶解的胶原蛋白,其物理性质与未经过蛋白酶作用的天然胶原蛋白几乎相同。
同时,Atelocollagen 还具有更优越的特性:
低抗原性
Atelocollagen 是经过蛋白酶处理的小牛皮来源的高纯度I型胶原蛋白。胶原蛋白分子在N端和C端具有一段氨基酸序列,称为端肽,胶原
蛋白的抗原性多来自于此。 Atelocollagen 通过蛋白酶的作用,去掉了端肽,故具有低免疫原性。
高纯度
Atelocollagen 的纯度极高。该特性得益于蛋白酶处理过程,该处理在提取去端肽胶原的过程中,因为蛋白酶的作用也分解了其他蛋白污
染物。
高度生物相容性
Atelocollagen 可生物降解,因此可用于各种领域,如医药,医疗器械,作为化妆品原理,及细胞培养研究。
高度可塑性
去端肽胶原可被改造成许多不同的物理性状,如膜、海绵状结构、带状结构、粉末和凝胶。我们可利用去端肽胶原的这一特性,生产适用
于任何领域的物理性状。例如,去端肽胶原不溶于中性水,但可以通过改变性状,使其溶于中性水中。同样,可以利用去端肽胶原的这一
特性,将其作为凝固剂或抗凝剂,并可以控制其被人体吸收的速率。
安全性
我们精确管理每一只用于生产去端肽胶原的牛,以确保原料的安全性。
A. 我们使用的牛真皮来自澳大利亚国家畜牧业溯源系统,牛龄为6月或更小的牛犊。
B. 我们不使用动物饲料喂养牛羊,只用无疯牛病的安全饲料。
C. 我们只使用牛皮的真皮层,其被归于“无传染性”类(WHO对传染性海绵状脑病组织感染性分布准则)。
收集的过程中,我们非常小心防止真皮层与危害部位接触,如大脑和脊柱。
D. 我们能够对胶原蛋白生产的原料进行溯源。
Q2: 转染试剂盒内的去端肽胶原溶液和医用级别的去端肽胶原溶液有何区别?
A2: 我们对试剂盒内的去端肽胶原浓度以及缓冲液成分进行了优化,以提高siRNA的转染效率;使用的去端肽胶原与医用级别的制造工艺相同,
故该转染试剂盒对试验动物非常安全,且具有高度生物相容性。
Q3: AteloGene® 活体转染的优势
A3: AteloGene® 和合成的小RNA即混即用
● 专门用于 siRNA/miRNA 体内转染
● 保护小 RNA 不被 RNase 降解,延长作用时间
● AteloGene® 无毒性,其组成成分去端肽胶原具有高生物相容性
● 使用 AteloGene® Local Use,局部给药,给药后,会在体内形成局部凝胶,保持 siRNA 停留在给药部位。
● 使用 AteloGene® Systemic Use,通过尾静脉注射,全身给药。 给药后,不会在体内形成凝胶,尾静脉注射,通过血液循环,siRNA
被有效的输送到全身。
Q4: AteloGene® 与 siRNA 复合物在血液中稳定吗?
A4: 我们已经证明,AteloGene® 与 siRNA 复合物能够抵御如RNA酶等物质的作用。
Atelocollagen 和 25 μg 的 siRNA 混合后,通过尾静脉注射,24小时后,可在不同组织中检测到 RNA 的存在。
参考文献 : Takeshita F, et al. Efficient delivery of small interfering RNA to bone-metastatic tumors
by using atelocollagen in vivo. (2005) Proc Natl Acad Sci USA. 102(34):12177-12182.
Q5: 能否使用市面上,传统的胶原蛋白进行 siRNA 转染?
A5: 我们不建议这样做,因为您需要根据具体条件进行额外的实验。
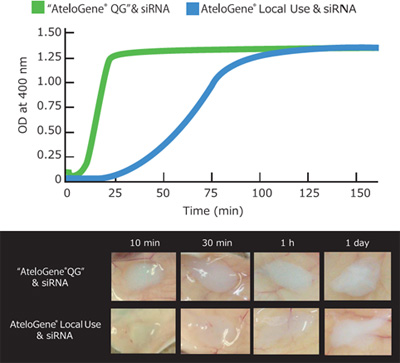
Q6: AteloGene® QG 与 AteloGene® 两款产品有何区别?
A6:
|
AteloGene® QG |
AteloGene® |
|
给药后,快速形成局部凝胶 |
给药后,释放速度受到控制 |
|
至少可给药15次。 |
至少可给药10次。 |
AteloGene® QG与AteloGene® 凝胶形成时间对比:
Q7: 能否使用 AteloGene® 转染体外培养细胞?
A7: AteloGene® 是专门为体内转染而研发的,因此我们不建议您用于体外实验。
体外转染研究,推荐您使用 Cosmo Bio 的 GenomONE™ 仙台病毒包膜转染试剂盒,可转染 DNA、siRNA、ODN、蛋白抗体等分子;该
产品使用安全,可替代传统的病毒转染及脂质体转染方法。GenomONE™ 的更多资料,请向我司索取。
Q8: AteloGene® 能否用于质粒 DNA 转染?
A8: AteloGene® 是专门用于siRNA转染的产品,因此我们不建议您用于质粒 DNA 转染。
以下两篇是使用 AteloGene® 转染质粒DNA的文献,供您参考:
a. 内皮功能障碍研究,静脉注射
Shinozaki K, et al. (2005)Cardiovasc Pharmacol. 46(4):505-512.
b. 脑胶质瘤研究,肿瘤内给药
El Sayed SM, et al. (2012) Cancer Gene Ther. 19(1):1-18.
Q9: 能否提供免费试用装,用于评估产品效果?
A9: 我们无法提供免费试用装。
(AteloGene® 已有大量文献和研究证明其有效性,如果您需要相关领域的运用情况,请查看文献列表)
Q10:AteloGene® 与 siRNA 复合物在血液中稳定吗?
A10:我们已经证明,AteloGene® 与 siRNA 复合物能够抵御如 RNA 酶等物质的作用。
具体请参考“RNAi 效率”相关文献。
Takeshita F, et al. Efficient delivery of small interfering RNA to bone-metastatic tumors by using atelocollagen in vivo. (2005)
Proc Natl Acad Sci USA. 102(34):12177-12182."
Q11: 试剂盒组成?
A11: 1 Kit 按照最大剂量计算,至少可用 10 次。
– 预充式注射器 600 µL×2 (每只注射器内预填充的“AteloGene®”至少可给药5次)
– 10×siRNA 缓冲液: 3 mL×1瓶
– 无菌水:3 mL×1瓶
– 微型管:2.0 mL×2管
– 一次性注射器: 1 mL×2只
– 18G 注射、抽吸用针头:4只
– 26G 注射针头: 2只
– 说明书:1份
Q12: AteloGene® 如何使用?
A12: 具体操作请参照产品说明书。
1) 准备AteloGene®
将预充式注射器内的AteloGene® 转移到微管中,并放置于冷却设备上保持低温。
2) 准备siRNA溶液
根据局部给药和全身给药的情况,分别准备 600 µL 5-10 µM 或 20-40 µM siRNA 溶液,并保持低温。
3) 制备 AteloGene® 与 siRNA 的混合溶液
将 siRNA溶液(步骤2)缓慢加入 AteloGene®(步骤1),通过上下旋转混合,得到 AteloGene® 和 siRNA 混合物,以上操作均在
冷却设备中进行。
4) 消除气泡及准备给药
将第3步得到的混合物离心,去除气泡后,吸入一次性注射器内。
<局部给药>
注射 AteloGene® 和 siRNA 复合物使其包裹整个靶标部位。每只小鼠的标准剂量为 200 µL 复合物。
● 局部给药案例
皮下肿瘤给药
a. 如有必要,请麻醉动物。
b. 在距肿瘤边缘 5 mm 的位置插入针头,针头截面向上。
c. 将针头平行于皮肤插入距离肿瘤 2~3 mm 的位置,然后缓慢的注射 200 µL AteloGene® 和 siRNA 复合物。使复合物包裹住整个
肿瘤。
<全身给药>
每只小鼠的标准剂量为 200 µL AteloGene® 和 siRNA 复合物。
每次注射的上限是 200 µL,请确保不会超过这个剂量。
a. 如有必要,请麻醉动物。
b. 固定小鼠。
c. 用浸润乙醇的棉签擦拭消毒小鼠尾巴。
d. 将针头插入尾部静脉1/4-1/3处,该部位应该是完全膨胀。
e. 确认针头插入了正确的部位,然后缓慢的注入 200 µL AteloGene® 和 siRNA 复合物。
f. 确认小鼠恢复正常。
Q13: 储存注意事项
A13: 产品需储存于2-10℃(不可冷冻)。
★ 当温度高于20℃时,AteloGene® 会发生凝胶化和热变性,如果产品已经发送凝胶化和热变性,请立即停止使用。
★ 冷冻 AteloGene® 会导致混合物中产生分散性气泡,请勿使用冷冻后的 AteloGene® 进行实验。
Q14: 产品有效期
A14: 产品生产后3年有效。
Q15: 使用注意事项
A15:1) 该试剂仅供科研使用,禁止用于人体实验。请勿用于科研以外的任何目的。
2) 务必在使用前仔细阅读说明书,制造商不对超出说明书使用方法得到的结果承担任何责任。
3) 转染效率取决于siRNA序列、靶基因的表达水平、不同组织和给药方式等多方面因素,可能并不总是得到预期的效果。
实验前,请您调查好给药后的作用持续时间及分析方法。
Q16: 操作注意事项
A16: 在洁净的环境下进行所有步骤:
● 使用恰当的方法消除 RNA 酶,避免的 siRNA 的降解。
● 在储存过程中,10×siRNA 缓冲液可产生结晶。如出现这种情况,使用之前将其加热到约 37℃,使之完全溶解。
● 使用 AteloGene® 和 siRNA 的混合物前,确保气泡已完全消除。
| AteloGene® 参考文献_全身给药 | ||||
| ◆全身给药/癌症研究 | ||||
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 前列腺癌, 肺癌 | siRNA | 静脉注射,肿瘤内 | Takahashi M, et al. (2013) PLoS One 8(8): e73214. | 23951344 |
| 口腔鳞状细胞癌 | miRNA | 静脉注射 | Tanaka H, et al. (2013) Oral Oncol. 49(6):551-559. | 23481312 |
| 非小细胞肺癌, 乳腺癌 | siRNA | 静脉注射 | Mochizuki S, et al. (2012) J Natl Cancer Inst. 104(12):906-922. | 22636800 |
| 骨肉瘤转移 | miRNA | 静脉注射 | Osaki M, et al. (2011) Mol Ther.19(6):1123-1130. | 21427707 |
| 前列腺癌 | siRNA | 静脉注射 | Azuma K, et al. (2010) Biochem Biophys Res Commun. 391(1):1075-1079. | 20004643 |
| 前列腺癌 | siRNA | 静脉注射 | Sasaki T, et al. Biochem Biophys Res Commun. (2010) 399(1):79-83. | 20638364 |
| 转移性前列腺癌 | miRNA | 静脉注射 | Takeshita F, et al. (2010) Mol Ther.18(1):181-187. | 19738602 |
| 前列腺癌 | siRNA | 静脉注射 | Mu P, et al. (2009) Int J Cancer.125(12):2978-2990. | 19422046 |
| 前列腺癌 | siRNA | 静脉注射 | Hokaiwado N, et al. (2008)Carcinogenesis. 29(6):1134-1138. | 18413363 |
| 转移性前列腺癌 | siRNA | 静脉注射 | Takeshita F, et al. (2005) Proc Natl Acad Sci USA. 102(34):12177-12182. | 16091473 |
| ◆全身用药/ 多项研究 | ||||
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 自身免疫性炎症 | siRNA | 静脉注射 | Raveney BJ, et al. (2013) PLoS One. 8(2):e56595. | 23437182 |
| 血管内皮细胞通透性 | – | – | Hanai K, et al. (2012) J Drug Delivery.Article ID 245835. | 22506120 |
| 接触性超敏反应 | siRNA | 静脉注射 | Inaba S, et al. (2012) Mol Ther.20(2):356-366. | 22031237 |
| 自身免疫性糖尿病 | siRNA | 腹腔 | Lian G, et al. (2012) J Immunol.188(5):2227-2234 . | 22291182 |
| 血管炎性疾病 | miRNA | 静脉注射 | Sun X, et al. (2012) J Clin Invest.122(6):1973-1990. | 22622040 |
| 毒品和化学诱导急性肝损伤 | siRNA | 静脉注射 | Yoshikawa Y, et al. (2012) Toxicol Appl Pharmacol. [Epub ahead of print] | 22841776 |
| 肢带型肌营养不良症 | siRNA | 静脉注射 | Kawakami E, et al. (2011) Dev Growth Differ. 53(1):48-54. | 21261610 |
| 关节炎 | miRNA | 静脉注射 | Nakasa T, et al. (2011) 关节炎 Rheum.Jun;63(6):1582-1590. | 21425254 |
| 肝毒性比较 | – | 静脉注射 | Ogawa S, et al. (2011) J Toxicol Sci.36(6):751-762. | 22129739 |
| 自身免疫性糖尿病 | siRNA | 腹腔 | Yamada A, et al. (2010) PLoS One.5(9):e12894. | 20877570 |
| 接触性超敏反应 | siRNA | 静脉注射 | Ishimoto T, et al. (2008) Mol Ther.16(2):387-395. | 18059372 |
| 肌营养不良症 | siRNA | 静脉注射 (眼眶静脉) |
Kinouchi N, et al. (2008) Gene Ther.15(15):1126-1130. | 18323791 |
| 接触性超敏反应 | antisense ODN | 静脉注射 | Hanai K, et al. (2004) Hum Gene Ther.15(3):263-272. | 15018735 |
| AteloGene® 参考文献_局部给药 | ||||
| ◆局部给药/癌症研究 | ||||
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 肝细胞癌 | siRNA | 肿瘤内 | Deng Q, et al. (2013) Hepatology. [Epub ahead of print] | 23929653 |
| 口腔癌 | siRNA | 瘤周 | Endo H, et al. (2013) Carcinogenesis. 34(3):560-569. | 23233740 |
| 骨肉瘤. | siRNA | 肿瘤内 | Fujiwara-Okada Y, et al. (2013) Br J Cancer. 108(4):836-847. | 23462806 |
| 乳腺癌 | siRNA | 肿瘤内 | Kabuta T, et al. (2013) J Biol Chem. [Epub ahead of print] | 23543736 |
| 前列腺癌 | siRNA | 瘤周 | Nomura T et al. (2013) Mol Cancer. 12:27. | 23566222 |
| 肾癌 | siRNA | 瘤周 | Takeuchi A, et al. (2013) Cancer Immunol Immunother. 62(3):517-527. | 23052245 |
| 脑胶质瘤 | siRNA | 肿瘤内 | Yamaki T, et al. (2013) Sci Rep. 3:1160. | 23362460 |
| 前列腺癌 | siRNA | 肿瘤内 | Kawamura M, et al. (2012) Cell Death Differ. 19(1):170-179. | 21681193 |
| 早衰 | siRNA | 瘤周 | Kim BC et al. (2012) EMBO J.31(22):4289-4303. | 23085987 |
| 前列腺癌 | shRNA | 瘤周 | Koike K, et al. (2012) Curr Cancer Drug Targets. 12(7):847-856. | 22515525 |
| 脑胶质瘤 | siRNA | 瘤周 | Okazaki T, et al. (2012) Cancer Lett.323(2):199-207. | 22542810 |
| 脑胶质瘤 | plasmid | 肿瘤内 | El Sayed SM, et al. (2012) Cancer Gene Ther. 19(1):1-18. | 21921941 |
| 尿路上皮癌 | siRNA | 经尿道前列腺 | Shimada K, et al. (2012) Clin Cancer Res. 18(19):5247-5255. | 22850567 |
| 间皮瘤 | siRNA | 瘤周 | Sudo H, et al. (2012) Cancer Sci.103(2):203-209. | 22017350 |
| 胚胎癌 | siRNA | 瘤周 | Ushida H, et al. (2012) J Urol.187(5):1876-1881. | 22425046 |
| 肺腺癌 | siRNA | 肿瘤内 | Yamaguchi T, et al. (2012) Cancer Cell.21(3):348-361. | 22439932 |
| 胰腺癌 | siRNA | 肿瘤内 (原位模型) |
Yamato I, et al. (2012) Cancer Res.72(18):4829-4839 | 22826605 |
| 脑胶质瘤 | siRNA | 瘤周 | Andradas C, et al. (2011) Oncogene.30(2):245-252. | 20818416 |
| 头颈部鳞状细胞癌 | siRNA | 瘤周 | Arai A, et al. (2011) Cancer Res.71(13):4598-4607. | 21571861 |
| 乳腺癌 | siRNA | 血管新生试验管(angioreacter)内 | Hashimoto A, et al. (2011) PLoS One.6(8):e23359. | 21858086 |
| 胰腺癌 | siRNA | 肿瘤内 | Kobayashi T, et al. (2011) Clin Exp Metastasis. 28(4):367-376. | 21331750 |
| 脑胶质瘤 | siRNA | 肿瘤内 | Lorente M, et al. (2011) Cell Death Differ. 18(6):959-973. | 21233844 |
| 间变性大细胞淋巴瘤 | miRNA inhibitor |
瘤周 | Matsuyama H, et al. (2011) Blood.118(26):6881-6892 | 22042699 |
| 结肠癌 | siRNA | 肿瘤内 | Oh BY, et al. (2011) World J Gastroenterol. 17(20):2563-2571. | 21633662 |
| 肝细胞癌 | siRNA | 瘤周 | Shigematsu S, et al. (2011) Exp Cell Res. 317(13):1851-1859. | 21624362 |
| 硬胃癌 | miRNA expression vector | 肿瘤内 (原位模型) |
Takei Y, et al. (2011) Cancer Res.71(4):1442-1453. | 21169410 |
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 尤因氏肉瘤 | siRNA | 肿瘤内 | Takigami I, et al. (2011) Int J Cancer.128(1):216-226. | 20648560 |
| 非小细胞肺癌 | siRNA | 瘤周 (原位模型) |
Tasaki M, et al. (2011) Br J Cancer.104(4):700-706. | 21285982 |
| 肾细胞癌 | siRNA | 瘤周 | Tomita S, et al. (2011) Cancer Sci.102(1):57-63. | 21054677 |
| 子宫内膜癌 | miRNA | 瘤周 | Tsuruta T, et al. (2011) Cancer Res.71(20):6450-6462. | 21868754 |
| 肝细胞癌 | siRNA | 瘤周 | Vara D, et al. (2011) Cell Death Differ.18(7):1099-1111. | 21475304 |
| 前列腺癌 | siRNA | 肿瘤内 | Zeng Y, et al. (2011) J Biol Chem.286(16):13985-13994. | 21357425 |
| 乳腺癌 | siRNA | 内部乳腺脂肪垫(原位模型) | Cheng L, et al. (2010) Oncogene.29(42):5700-5711. | 20676140 |
| 前列腺癌 | siRNA | 瘤周 | Forootan SS, et al. (2010) Int J Oncol.36(1):69-76. | 19956834 |
| 宫颈癌 | siRNA | 瘤周 | He L, et al. (2010) J Clin Invest.120(6):2094-2108. | 20458142 |
| 头颈癌 | miRNA inhibitor | 瘤周 | Liu CJ, et al. (2010) Cancer Res.70(4):1635-1644. | 20145132 |
| 骨髓瘤 | siRNA | 瘤周 | Marsaud V, et al. (2010) Mol Cancer.9:103. | 20459741 |
| 尤因氏肉瘤 | siRNA | 肿瘤内 | Nagano A, et al. (2010) Int J Cancer.126(12):2790-2798. | 19642105 |
| 肝细胞癌 | siRNA | 肿瘤内 | Satow R, et al. (2010) Clin Cancer Res.16(9):2518-2528. | 20388846 |
| 大肠癌 | siRNA | 肿瘤内 | Shitashige M, et al. (2010) Cancer Res.70(12):5024-5033. | 20530691 |
| 间皮瘤 | siRNA | 瘤周 | Sudo H, et al. (2010) Genomics.95(4):210-216. | 20153416 |
| p53基因突变 | siRNA | 瘤周 | Tanooka H, et al. (2010) Cancer Gene Ther. 17(1):1-10. | 19557034 |
| 骨髓瘤 | siRNA | 瘤周 | Ashihara E, et al. (2009 ) Clin Cancer Res. 15(8):2731-2738. | 19351774 |
| 脑胶质瘤 | siRNA | 瘤周 | Lorente M, et al. (2009) Glia.57(13):1374-1385. | 19229996 |
| 膀胱癌 | siRNA | 经尿道前列腺 | Shimada K, et al. (2009) Cancer Res.69(7):3157-3164. | 19293182 |
| 前列腺癌 | siRNA | 瘤周 | Shimada K, et al. (2009) Cancer Sci.100(7):1248-1254. | 19432893 |
| 骨肉瘤 | siRNA | 肿瘤内 | Yamaguchi U, et al. (2009) Cancer Sci.100(12):2268-2274. | 19725836 |
| 乳腺癌 | siRNA | 肿瘤内 | Bernard-Pierrot I, et al. (2008) Cancer Res. 68(17):7165-7175. | 18757432 |
| 乳腺癌 | siRNA | 肿瘤内 (原位模型) |
Honma K, et al. (2008) Nat Med.14(9):939-948. | 18724378 |
| 胰腺癌 | siRNA | 肿瘤内 | Iwaki K, et al. (2008) Int J Cancer.122(3):658-663. | 17935125 |
| 非小细胞肺癌 | siRNA | 瘤周 | Migita T, et al. (2008) Cancer Res.68(20):8547-8554. | 18922930 |
| 涎腺腺样囊性癌 | siRNA | 肿瘤内 | Shirasaki T, et al. (2008) BMC Cancer.8:348. | 19036131 |
| 黑色素瘤 | siRNA | 瘤周 | Ueno Y, et al. (2008) Int J Cancer.123(2):340-347. | 18398842 |
| 宫颈癌 | siRNA | 肿瘤内 | Yamato K, et al. (2008) Cancer Gene Ther. 15(3):140-153. | 18157144 |
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 宫颈癌 | siRNA | 肿瘤内 | Yu D, et al. (2008) Cancer Sci.99(4):810-815. | 18377429 |
| 胆管癌 | siRNA | 肿瘤内 | Kokuryo T, et al. (2007) Cancer Res.67(20):9637-9642. | 17942892 |
| 胃肠道肿瘤、横纹肌肉瘤 | antisense ODN | 肿瘤内, 腹腔, 肌内注射 | Nakazawa K, et al. (2007) Cancer.109(5):993-1002. | 17318877 |
| 结肠癌 | miRNA | 瘤周 | Tazawa H, et al. (2007) Proc Natl Acad Sci U S A. 104(39):15472-15477. | 17875987 |
| 卵巢癌 | siRNA | 瘤周 | Yamashita M, et al. (2007) Int J Cancer. 120(10):2243-2250. | 17266036 |
| 宫颈癌 | siRNA | 肿瘤内 | Fujii T, et al. (2006) Int J Oncol.29(3):541-548. | 16865269 |
| 头颈部鳞状细胞癌 | siRNA | 肿瘤内 | Nozawa H, et al. (2006) Cancer Sci.97(10):1115-1124. | 16984384 |
| 前列腺癌 | siRNA | 肿瘤内 | Takei Y, et al. (2006) Cancer.107(4):864-873. | 16832814 |
| 宫颈癌 | siRNA | 瘤周 | Kuroda M, et al. (2005) Br J Cancer.92(2):290-293. | 15655544 |
| 前列腺癌 | antisense ODN | 瘤周 | Takei Y, et al. (2005) Int J Cancer.114(3):490-497. | 15578698 |
| 非精原细胞瘤 | siRNA | 肿瘤内 (原位模型) |
Minakuchi Y, et al. (2004) Nucleic Acids Res. 32(13):e109. | 15272050 |
| 前列腺癌 | siRNA | 瘤周 | Takei Y, et al. (2004) Cancer Res.64(10):3365-3370. | 15150085 |
| 生殖细胞瘤 | antisense ODN | 瘤周 | Hirai K, et al. (2003) J Gene Med.5(11):951-957. | 14601132 |
| 直肠癌 | antisense ODN | 肿瘤内 | Takei Y, et al. (2002) J Biol Chem.277(26):23800-23806. | 11959856 |
| 直肠癌 | antisense ODN | 瘤周 | Takei Y, et al. (2001) Cancer Res.61(23):8486-8491. | 11731432 |
| ◆局部给药/ 多项研究 | ||||
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 肌肉萎缩 | siRNA | 肌内注射 | Kawakami E, et al. (2013) PLoS One. 8(5):e64719. | 23717655 |
| 骨折 | siRNA | 骨折部位 | Kawakami Y, et al. (2013) Lab Invest. [Epub ahead of print] | 23897412 |
| 硬皮病 | siRNA | 皮内注射 | Makino K, et al. (2013) J Immunol. 190(8):3905-3915. | 23509348 |
| 高血压 | siRNA | 显微注射到RVLM | Matsukawa R, et al. (2013) Am J Hypertens. 26 (1): 51-57. | 23382327 |
| 脊髓损伤 | siRNA | 鞘内注射 | Ando T, et al. (2012) PLoS One 7(12): e51744. | 20181596 |
| 纤维化 | siRNA | 皮内注射 | Distler A, et al. (2012) Ann Rheum Dis. 72(9):1575-1580. | 23148305 |
| 纤维化 | siRNA | 皮内注射 | Horn A, et al. (2012) Ann Rheum Dis. 71:785-789. | 22402139 |
| 纤维化 | siRNA | 皮内注射 | Khodzhigorova A, et al. (2012) Ann Rheum Dis. [Epub ahead of print] | 22904261 |
| 哮喘 | siRNA | 气管导管 | Liu S, et al. (2012) Immunol Cell Biol. 90(3):337-345. | 21625250 |
| 角膜损伤 | shRNA | 结膜 | Bellner L, et al. (2011) Mol Vis.17:1144-1152. | 21552471 |
| 高血压 | siRNA | 显微注射到RVLM | Matsukawa R, et al. (2011) J Hypertens. 29(9):1735-1742. | 21738056 |
| 脊髓损伤 | siRNA | 脊髓挫伤表面 | Toyooka T, et al. (2011) J Neurotrauma. 28(4):607-618. | 21250919 |
| 研究领域 | 核酸 | 给药途径 | 参考文献 | PubMed ID |
| 肌肉损伤 | miRNA | 肌肉缺损区 | Nakasa T, et al. (2010) J Cell Mol Med. 14(10):2495-2505. | 19754672 |
| 关节炎 | miRNA | ntraarticular | Nagata Y, et al. (2009) 关节炎 Rheum. 60(9):2677-2683. | 19714650 |
| 进行性多灶性白质脑病 | siRNA | 显微注射到纹状体 | Matoba T, et al. (2008)Neuropathology. 28(3):286-294. | 18179406 |
| 内膜增生 | siRNA | 静脉移植物的表面 | Banno H, et al. (2006) J Vasc Surg. 44(3):633-641. | 16950446 |
| 内皮功能障碍 | plasmid | 肌内注射 | Shinozaki K, et al. (2005)Cardiovasc Pharmacol. 46(4):505-512. | 16160605 |
| 家族性淀粉样多发性神经病变 | single-stranded ODN | 肝脏 | Nakamura M, et al. (2004) Gene Ther. 11(10):838-846. | 14961068 |
| 腺病毒载体重复给药 | adenovirusvector | 腹腔 | Ochiya T, et al. (2001) Curr Gene Ther. 1(1):31-52. | 12109137 |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| KOU-1392 | AteloGene® Local Use AteloGene ® siRNA活体转染试剂盒,局部 |
1 kit | 用于体内局部小RNA转染 | – |
| KOU-1393 | AteloGene® Systemic Use AteloGene ® siRNA活体转染试剂盒,全身 |
1 kit | 用于体内全身小RNA转染 | – |
| KOU-1492 | AteloGene® Local Use Quick Gelation AteloGene ® siRNA活体转染试剂盒,局部,快速凝胶 |
– | 用于体内局部小RNA转染 | – |
ScreenFect™ siRNA
ScreenFect™ siRNA
siRNA Transfection Reagent
◆原理
ScreenFect ™ siRNA 是点击化学※ 筛选实验选出的阳离子脂质体的新型转染试剂,适用于转染多种真核细胞(HeLa,HEK293,MEF cell 等),可直接添加于血清培养基。由于低细胞毒性不含任何有毒有害成分,转染后无须更换培养基。
◆特点•优势
• 高基因沉默效率 & 极低细胞毒性 & siRNA 使用量低至 1 nM
• 提供能优化 siRNA 转染的缓冲液
• 转染后无须更换培养基
• 能与血清兼容
• 可用于高通量筛选
• 保质期长达 12 个月
◆产品性能
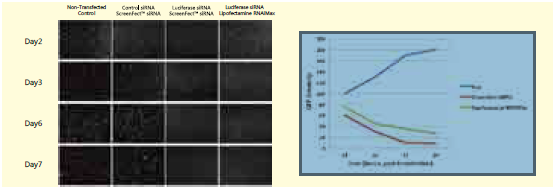
基因沉默效率 细胞毒性
|
|
|
|
细胞系:小鼠胚胎成纤维细胞 细胞培养板:24 孔 转染靶位点:LRP6 |
细胞株:HEK293 细胞 细胞培养板:96 孔 染色方法:赫斯特染色 |
ScreenFectTM siRNA 导入条件
siRNA:1 pmol
转染试剂:0.1 μL
悬浮细胞:420 μL
◆案例•应用
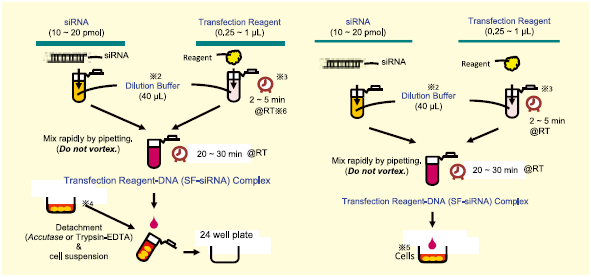
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 299-75001 | ScreenFect ™ siRNA Transfection Reagent | 0.2 mL | – | – |
| 295-75003 | ScreenFect ™ siRNA Transfection Reagent | 1 mL | – | – |
| 293-75004 | ScreenFect ™ siRNA Transfection Reagent | 5 × 1 mL | – | – |
DNA & siRNA 转染试剂
ScreenFect™ A plus
ScreenFect A+
DNA & siRNA 转染试剂!
◆原理
ScreenFect ™A+是通过点击化学(Click Chemistry)方法筛选出的阳离子脂质体转染试剂。适用于各种真核细胞,也可直接添加到含有抗生素或者血清的培养基中。使用 ScreenFect ™A+转染试剂可将 DNA 和 siRNA 转入常见实验室培养的细胞株(HeLa、HepG2、MDCK 等)、干细胞(小鼠ES细胞等),血液细胞(巨噬细胞、THP-1、RAW264 等),小胶质细胞和原代细胞。由于低细胞毒性,不含有任何有毒有害成分,转染后无需更换培养基。
※1 Biomaterials. 2012 Nov; 33(32):8160-6. 2012
◆优点、特色
● DNA 用量少。
● 高效一步转染法。
● 转染效率高&细胞毒性低。
● 使用成本低
◆案例、应用
【ScreenFect ™ A+ 转染性能(流式细胞仪检测)】
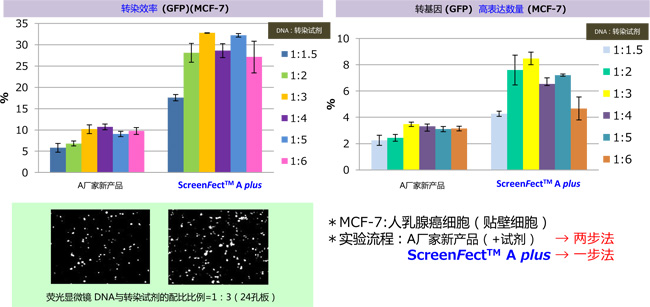
用于不同细胞的高效脂质体转染试剂!!
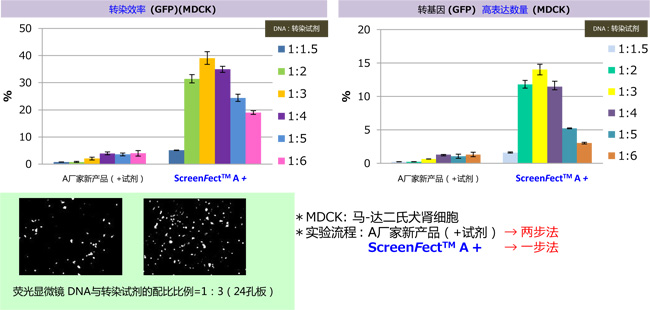
用于不同细胞的高效脂质体转染法!!
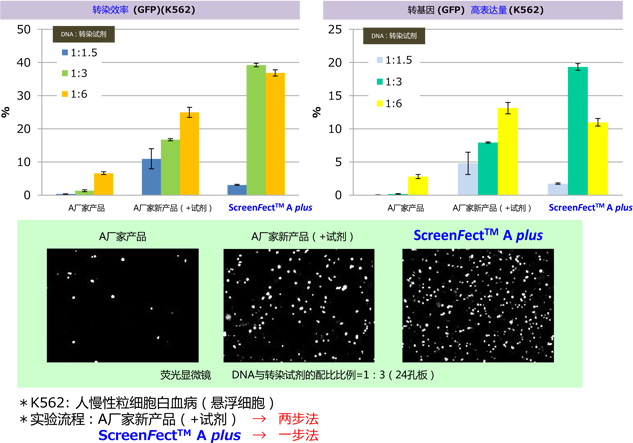
适用于难转染的悬浮细胞!!
一步法和两步法实验流程的比较
|
产品名称 |
ScreenFect ™ A plus |
A厂家新产品 (+试剂) |
A厂家产品 |
|
推荐的实验流程 |
一步法 |
两步法 |
|
|
实验用时 |
2天 |
3天 |
|
|
所需DNA量 |
低 |
高 |
|
|
细胞数目调整 |
灵活 |
不灵活 |
|
|
胰酶消化 |
需要 |
需要 |
|
|
适于高通量筛选 |
+++++ |
+ |
|
|
培养基的更换 |
取决于细胞系 |
||
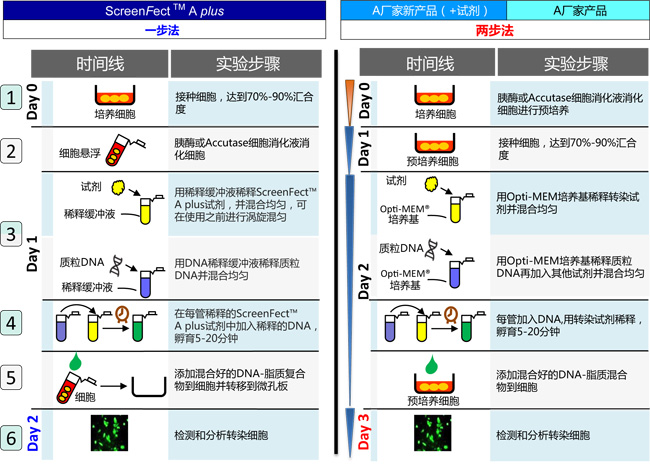
一步法比两步法节省24小时!

ScreenA+.pdf
高性价比的高性能基因导入试剂
ScreenFect ™ 通信
基因导入人 iPS 细胞实验数据
介绍使用 ScreenFect ™A plus 将基因导入人iPS细胞的实验结果和操作步骤。本文记载了作为 iPS 细胞支架使用的 Matrigel 孔板包被方法、配制含有 Y-27632 的细胞悬浮液的操作步骤以及最优的试剂比例,供您参考。
◆导入人iPS细胞(201B7株)的转染操作实例
在这里,我们将介绍一些使用 StemSure® hPSC 培养基Δ(产品编号:197-17571)的操作实例。该操作步骤的完整版和使用 mTeSR1 培养基的操作步骤,请查看 FUJIFILM Wako 公司的官网。http://db.screenfect.jp/ja/documents/list/protocol
<转染试剂的配制>
将 2.0 μL 的 ScreenFect ™ A plus reagent、4.0 μg 的质粒 DNA 加入到 160 μL 的 Opti-MEM 中制成 DNA-lipid complex。
< Matrigel 包被孔板>
1. 4°C下溶解 Matrigel hESC-Qualified Matrix 。为防止发生凝固,请避免在室温下溶解。
2. 用 25 mL 冷却的 D-MEM/Ham's F-12 稀释 300μL 的 Matrigel。
3. 稀释后的 Matrigel 溶液按照 1 mL/well 加入到 12 孔板中。
4. 在室温下孵育1小时以上。
<细胞悬液的配制>
1. 将 StemSure® hPSC 培养基Δ在 2-8℃ 下放置数小时或过夜缓慢融解。不要在 37° C下解冻,并在一周内使用。
2. 将 bFGF(产品编号:064-05381,068-05384)按照终浓度 35-100ng/mL 添加到融解后的 StemSure® hPSC 培养基△中,配制成完全培养基(以下称为 sshPSC 培养基)。
3. 使用前将 sshPSC 培养基恢复至室温。不要使用温水浴。
4. 将 Y-27632 按照终浓度 10 μmol/L 添加到 sshPSC 培养基中(以下称为 ROCKi+培养基)。
5. 去除 hiPS 细胞培养孔板中的培养基,用 PBS(-)清洗细胞一次。
*请在细胞汇片达到80%且处于对数增殖期时进行细胞转染。
6. 除去 PBS(-),添加 Stempro Accutase。
7. 在 37°C,5%CO2 培养箱中静置5分钟。
8. 用 1 mL 微量移液枪添加 ROCKi+培养基,将细胞从培养板上分离并吹散成单细胞。
9. 转移至 15 mL离心管中。
10. 室温下 1000 rpm(约170×g)离心3分钟。
11. 去除上清,用ROCKi+培养基重悬细胞。
12. 计算活细胞的数量。
13. 用 ROCKi+培养基将细胞浓度调整至 5×105 cells/mL。
<转染>
添加 1 mL 配制好的 DNA-lipid complex 到细胞悬液中,使用移液器充分混匀,并接种在 12 孔板中。
※要点
接种 24 小时后请更换培养基。此时的培养基不需要含有 Y-27632。
◆实验数据
通过反向转染(1-STEP)将 GFP 融合基因导入 hiPS 细胞(201B7株),并通过荧光显微镜比较基因的导入效率。
<StemSure® hPSC 培养基Δ的使用>
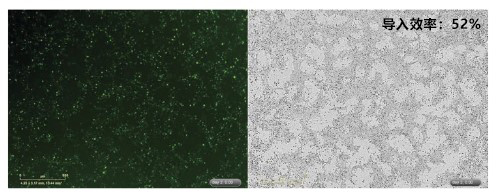
细胞数:5×105 cells/well
质粒 DNA 量:4 μg/assay
转染试剂混合比例:DNA 量(μg):ScreenFect ™ A plus reagent (μL)=1 : 0.5
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。
<mTeSR1 培养基的使用>

细胞数:5 x 105 cells/well
质粒 DNA 量:1 μg/assay
转染试剂混合比例:DNA数量(μg):ScreenFect ™ A plus reagent (μL)=1 : 2
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。
◆使用上的注意
● 建议在单细胞状态下进行人iPS细胞的基因导入。
● 建议基因导入时的细胞数约为 5×105 cells/well。
● 当质粒 DNA 量多时,导入基因的表达量高会引起细胞死亡。
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
293-77101 |
ScreenFect ™ A plus |
基因研究用 |
0.2 mL |
|
299-77103 |
1 mL |
||
|
297-77104 |
1 mL×5 |
|
[1] |
Diefenbacher, Markus E., et al. "The LIM Domain Protein nTRIP6 Recruits the Mediator Complex to AP-1-Regulated Promoters." PLoS ONE 9.5 (2014): e97549. |
|
[2] |
Freise, Christian, and Uwe Querfeld. "Inhibition of vascular calcification by block of intermediate conductance calcium-activated potassium channels with TRAM-34." Pharmacological Research (2014). |
|
[3] |
Hagiwara, Akane, et al. "Luteinizing Hormone-Induced Expression of Ptger4b, a Prostaglandin E2 Receptor Indispensable for Ovulation of the Medaka Oryzias latipes, Is Regulated by a Genomic Mechanism Involving Nuclear Progestin Receptor." |
|
[4] |
Peng, Yanyan, Ruidan Xu, and Xiaofeng Zheng. "HSCARG Negatively Regulates the Cellular Antiviral RIG-I Like Receptor Signaling Pathway by Inhibiting TRAF3 Ubiquitination via Recruiting OTUB1." PLoS pathogens 10.4 (2014): e1004041. (3) |
|
[5] |
Wakimoto, Hiroaki, et al. "Targetable signaling pathway mutations are associated with malignant phenotype in IDH-mutant gliomas." Clinical Cancer Research (2014). (2) |
|
[6] |
Fischer, Simon, et al. "Breaking limitations of complex culture media: Functional non-viral miRNA delivery into pharmaceutical production cell lines." Journal of biotechnology 168.4 (2013): 589-600. |
|
[7] |
Bai, Dongmei, et al. "Regulation of the HDM2-p53 pathway by ribosomal protein L6 in response to ribosomal stress." Nucleic acids research 42.3 (2014): 1799-1811. |
|
[8] |
Liu, Xing, et al. "Isocitrate dehydrogenase 2 mutation is a frequent event in osteosarcoma detected by a multi‐specific monoclonal antibody MsMab‐1." Cancer medicine 2.6 (2013): 803-814. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 293-77101 | ScreenFect™ A plus | 0.2 mL | – | – |
| 299-77103 | ScreenFect™ A plus | 1 mL | – | – |
| 297-77104 | ScreenFect™ A plus | 5 x 1 mL | – | – |