第2回 小胶质细胞的发育起源及脑疾病
小胶质细胞研究的前沿 —从基础到临床—
![]()
京都药科大学综合药科学院
高田 和幸
◆前言
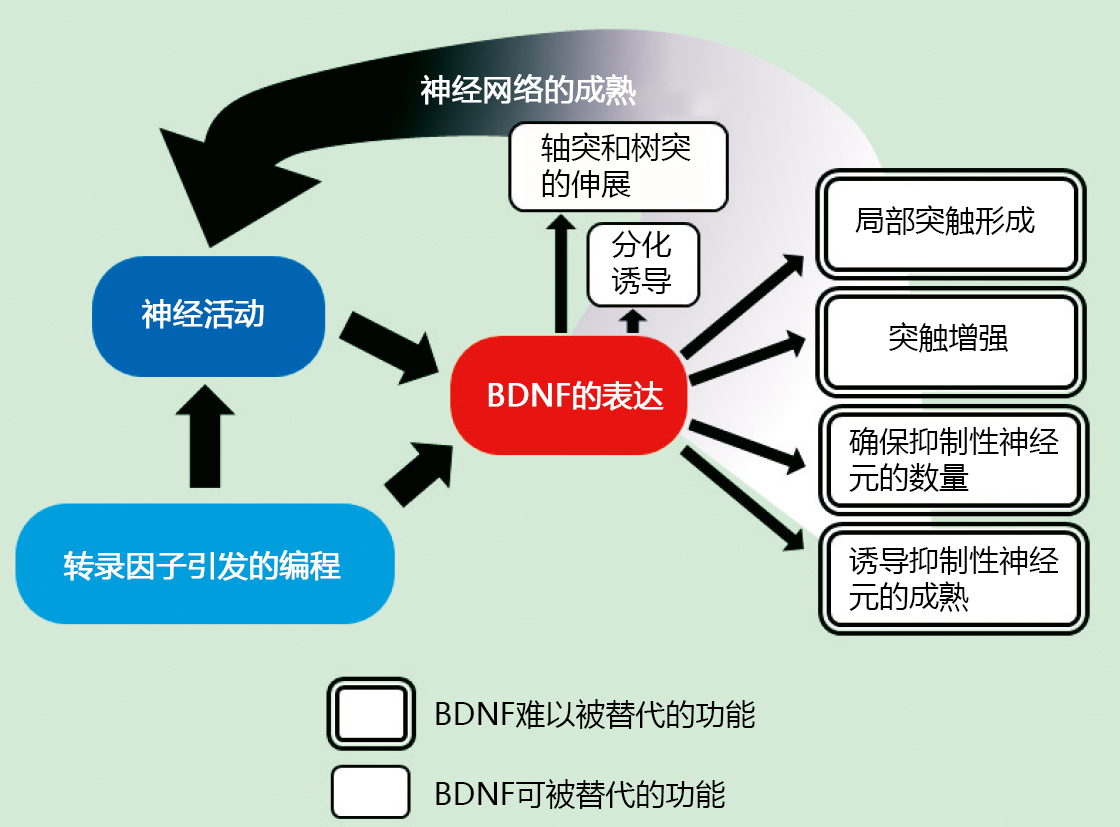
小胶质细胞是位于中枢(脑/脊髓)的组织巨噬细胞,在中枢系统位居免疫第一线。随着发育方式和生态特殊性的不断阐明,小胶质细胞备受各个学科领域的研究人员的关注,对小胶质细胞生物学的学术研究日益活跃。本文着眼于小胶质细胞的发育起源及其生态,并介绍其与脑疾病的相关性以及作为治疗靶点的地位。
◆小胶质细胞的发育
1919年,西班牙神经科学家Pío del Río Hortega生动地描述了仅次于神经细胞和星形胶质细胞的第三位大脑组成细胞群的形态学特征,并将该细胞群命名为小胶质细胞。Hortega还涉及到了小胶质细胞的发育起源,指出前体细胞是在大脑发育初期从大脑外部移入的。长期以来,其前体细胞被认为是外周血中的单核细胞,但十年前小鼠实验中利用胚外组织卵黄囊造血,发现产生的是“原始巨噬细胞”1)。该原始巨噬细胞是从被称为erythro-myeloid progenitor(EMPs)的细胞,不依赖于转录因子Myb2) ,不经过单核细胞生成的,遍及包括大脑在内的全身各个器官,暂时性形成组织巨噬细胞(图)。之后,EMPs转移至胎肝,继承了造血的场所后,此时在EMPs中产生Myb依赖性单核细胞(fetalliver monocytes)。这些单核细胞遍及全身,将先前已植入的原始巨噬细胞取代或与之共存,作为新的组织巨噬细胞形成种群3)。此时,大脑中已经形成发育阶段的血脑屏障,几乎不会被入侵。也就是说,在全身器官中存在常在性组织巨噬细胞时,只有小胶质细胞把在卵黄囊中产生的原始巨噬细胞作为主要的发育起源。
◆根据细胞起源赋予小胶质细胞的特点
由于EMPs延缓造血,在胚胎期的主动脉-性腺-中肾(aorta-gonad-me-sonephros : AGM)区域中形成造血干细胞(hematopoietic stem cells HSC)(图)。HSCs也在小鼠胎肝中开始胎儿期的二次造血,但在出生前不久会转移至骨髓,全面担任出生后的二次造血。HSCs来源的单核细胞也被认为是组织巨噬细胞的来源之一,但在生理条件下,它对小胶质细胞种群几乎没有任何贡献1,4)。另外,HSCs来源单核细胞随血液循环全身,响应感染和受损信号并转移至组织,分化成巨噬细胞。这些HSCs单核细胞来源的巨噬细胞生命短暂,并且会在组织中暂时性停留引起炎症反应,而EMPs来源的组织常在性巨噬细胞主要作用于营养和组织重塑。此外,HSCs来源巨噬细胞高表达趋化因子受体CCR2,EMPs来源巨噬细胞高表达F4 / 80、colony-stimulating factor-1 receptor(CSF-1R)和分形碱受体CX3CR1,不同的基因表达模式中都深刻地残留了细胞起源4),估计与功能角色划分相关。CSF-1R介导的信号诱导microRNA-21,抑制炎症因子的表达并促进营养因子的表达5);这在以小胶质细胞为代表的EMPs来源组织巨噬细胞的细胞起源伴随的功能特征的说明上来说也让人十分感兴趣。最近有研究推测,存在于与脑实质成为边界的血管周围间隙、硬脑膜和脉络丛中的巨噬细胞(border-associated macrophages : BAMs)和实质小胶质细胞,不仅与卵黄囊EMPs的细胞起源相同,而且在卵黄囊存在的时刻就已经决定了各自的命运6),并且还明确了BAMs与小胶质细胞的基因表达模式的区别7)。如此一来,小胶质细胞这一组织巨噬细胞在特点上,就不仅可以从植入目的地中的大脑和脊髓这样的环境中接收信号,还可以很大程度地反映从其独特的发育起源受到的影响。所以想要更深入并且更准确地理解小胶质细胞的生态和功能的话,就必须充分考虑其发育起源。
◆维持小胶质细胞种群
如上所述,小胶质前体细胞仅在胎儿期产生,出生后由骨髓HSCs来源单核细胞几乎很少参与小胶质细胞的补充。关于维持该小胶质细胞出生后的种群数,近年的报告显示,在小鼠大脑中的所有小胶质细胞以约96天为周期发生周期性交换,重复细胞死亡(凋亡)和分裂的过程,来稳定脑内的细胞数量8)。这种利用自我分裂来维持种群的模式,以表观遗传修饰的形式,分裂后的细胞也传达发育起源。此外,不时还会继承植入后在中枢内时刻发生变化的微环境的信息,估计与时空依赖性的小胶质细胞亚群和脑疾病中特异性亚群的出现密切相关9,10)。
◆小胶质细胞与脑疾病
21号染色体三体引发的Down syndrome(DS),在胎儿期神经发生减少的原因至今尚未阐明。在与京都药科大学的石原庆一博士等人的共同研究中,分析DS模型小鼠时发现,在胎儿期的大脑中,包含小胶质细胞在内的脑组织巨噬细胞的比例减少,中性粒细胞以及单核细胞等炎症细胞的比例增加,由此看出大脑皮层中神经新生降低11)(图)。 结果表明,包含小胶质细胞在内,在胎儿期的大脑免疫环境的破绽与DS的病发密切相关,其正常化将是DS胎内治疗法中新的治疗目标。
另一方面,Alzheimer’s disease(AD)的最大风险因素就是年龄衰老,发病前几十年间在大脑中积蓄的淀粉样蛋白-β(Aβ)被当做是病态形成的诱因。而且很久以前我们就知道小胶质细胞会在Aβ聚集部位(老年斑)积蓄。考虑到小胶质细胞通过自我分裂来维持种群的机构,或许年龄衰老、Aβ长时间暴露等积累的小胶质细胞性质的变化,正是连接从Aβ到AD发病的主要途径。我们从小鼠骨髓和外周血中收集HSCs,在CSF-1的刺激下制备巨噬细胞,将其移植至可呈现脑内Aβ积蓄的AD小鼠模型的海马体中,发现小鼠的认知功能障碍得到了改善13,14)(图)。最初认为是只有移植的巨噬细胞的Aβ吞噬带来了治疗效果的作用机制,但结果发现,是该移植细胞分泌的transforming growth factor-β1(TGF-β1)引起的小胶质细胞的功能变化也与治疗相关15)。有报告称TGF-β信号在发育初期阶段中,从原始巨噬细胞转变为小胶质细胞的命运是必须的6)。另一方面还有报告称,去除包含小胶质细胞在内的老化胶质细胞与改善认知功能相关16)。由于Aβ长期暴露和年龄衰老的累积,导致小胶质细胞的性质改变降低认知功能,小胶质细胞发育初期所须的TGF-β信号会抵消部分变化,这或许与改善认知功能相关。
◆结语
在小胶质细胞通过重复自我分裂来维持种群的机构中,遗传其发育起源和植入后的微环境信息以表观遗传修饰的形式继承,从而获得小胶质细胞时空依赖性的特点。我们在与Agency for Science, Technology and Research(A*STAR)的 Florent Ginhoux博士的共同研究中,已成功从多能诱导干细胞(iPS)细胞中制备可反映胎儿早期造血的原始巨噬细胞(iMacs)17)(图)。像这样使用原始细胞再现发育起源的分析,有望引导我们进一步正确的理解小胶质细胞的生态。为研究大脑从发育到衰老各阶段引起的脑疾病发病机制,为了获取开发治疗发的线索,有必要正确地了解小胶质细胞发育、成熟和衰老等阶段。将巨噬细胞移植至AD模型小鼠的研究是与札幌医科大学的下滨俊教授、京都药科大学的芦原英司教授、立命馆大学的北村佳久教授的共同研究。
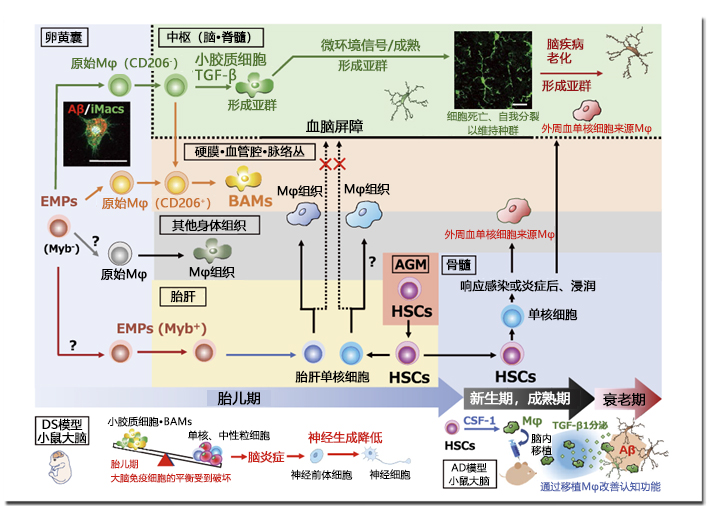
图. 包含小胶质细胞在内的组织巨噬细胞的发育与脑疾病的关联
在小鼠卵囊中,EMPs不经过转录因子Myb非依赖性单核细胞生成原始Mφ,并作为包含小胶质细胞的Mφ组织植入至各组织中。小胶质细胞和去往BAMs的方向在此时确定,小胶质细胞的分化需要TGF-β信号。其他原始Mφ的方向尚未明确。之后,向胎肝移动的EMPs生成胎肝单核细胞,一边替换原始φ或与原始φ共存,一边形成新组织Mφ,但由于中枢中存在血脑屏障而未被替换。随后,在AGM区域产生的HSCs来源单核细胞,在生理条件下也不会变成小胶质细胞,而是响应感染/受损信号,从血液中转移至组织成为Mφ。小胶质细胞的发育起源是卵黄囊的原始Mφ,之后通过细胞死亡和自我分裂维持种群。在DS模型小鼠胎儿期的大脑内,小胶质细胞和BAMs的比例减少,炎症细胞的比例增加,神经发育降低11)。将通过CSF-1刺激的HSCs制备的Mφ移植至AD模型小鼠中后,移植细胞不仅会吞噬Aβ,还会分泌TGF-β1促进内源性小胶质细胞的Aβ吞噬,从而改善认知功能障碍13-15)。
左图: 再现iPS细胞来源Mφ(iMacs)是原始Mφ的发育过程,可分化诱导小胶质细胞,显示Aβ吞噬功能。(Scale bars:20 μm)
右图:成年小鼠海马体的小胶质细胞(经过Goat抗Iba1抗体染色)。(Scale bars:20 μm)
Aβ: amyloid- β , AD: Alzheimer’s disease,
AGM: aorta-gonad-mesonephros,
BAMs: border-associates macrophages,
CSF-1: colony-stimulating factor -1,
DS: Down syndrome,
EMPs: erythro-myelord progenitors,
HSCs: hematopoietic stem cells,
Mφ: macrophages ,
TGF-β: transforming growth factor-β。
点击此处,了解小胶质细胞标志物Iba1抗体更多资讯。
◆参考文献
1) Ginhoux, F. et al. : Science, 330, 841(2010).
2) Schulz, C. et al. : Science, 336, 86(2012).
3) Hoeffel, G. et al. : Immunity, 42, 665(2015).
4) Hagemeyer, N. et al. : EMBO J., 35, 1730(2016).
5) Caescu, C. I. et al. : Blood, 125, e1(2015).
6) Utz, S. G. et al. : Cell, 181, 557(2020).
7) Mrdjen, D. et al. : Immunity, 48, 380(2018).
8) Askew, K. et al. : Cell Rep., 18, 391(2017).
9) Masuda, T. et al. : Nature, 566, 388(2019).
10) Keren-Shaul, H. et al. : Cell, 169, 1276(2017).
11) Ishihara, K. et al. : Brain Pathol., 30, 75(2020).
12) Baik, S. H. et al. : Cell Metab., 30, 493(2019).
13) Kawanishi, S. et al. : J. Alzheimers Dis., 64, 563(2018).
14) Kuroda, E. et al. : J. Alzheimers Dis., 73, 413(2020).
15) Kuroda, E. et al. : Neuroscience, 438, 217(2020).
16) Tyler, B. et al. : Nature, 502, 578(2018).
17) Takata, K. et al. : Immunity, 47, 183(2017).