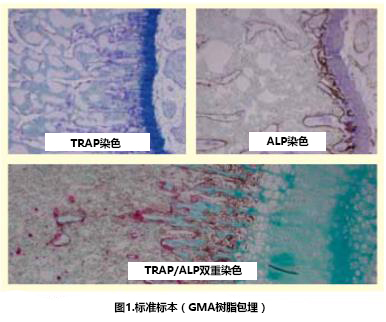
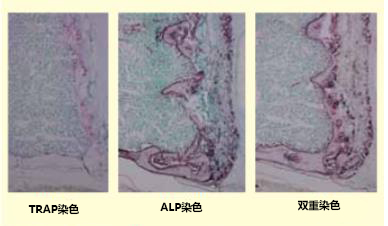
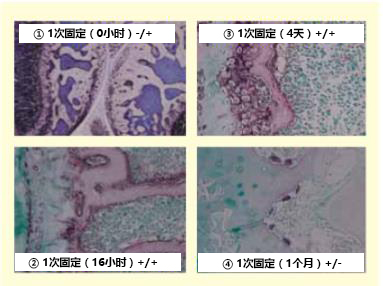
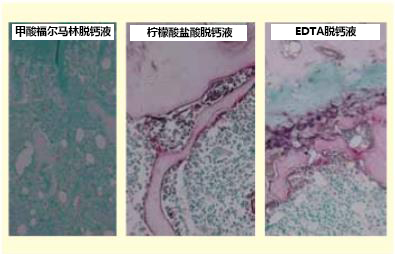
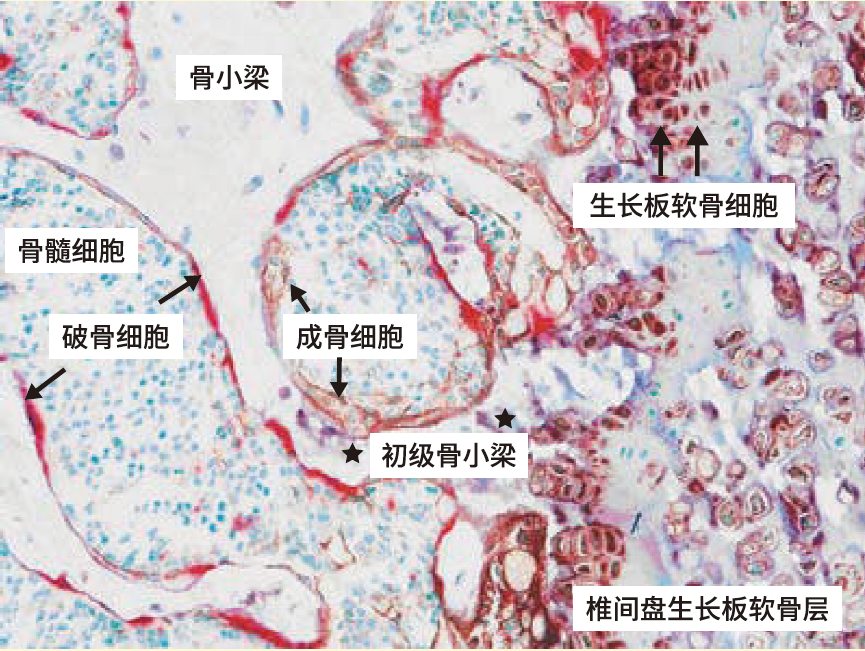
1.
|
Yamaguchi, S., Aoyama, T., Ito, A., Nagai, M., Iijima, H., Tajino, J., … & Kuroki, H. (2016). Effect of low-intensity pulsed ultrasound after mesenchymal stromal cell injection to treat osteochondral defects: an in vivo study. Ultrasound in medicine & biology, 42(12), 2903-2913. 全文
|
2.
|
Pang, P., Shimo, T., Takada, H., Matsumoto, K., Yoshioka, N., Ibaragi, S., & Sasaki, A. (2015). Expression pattern of sonic hedgehog signaling and calcitonin gene-related peptide in the socket healing process after tooth extraction. Biochemical and biophysical research communications, 467(1), 21-26. 全文
|
3.
|
Hatano, K., Ishida, Y., Yamaguchi, H., Hosomichi, J., Suzuki, J. I., Usumi-Fujita, R., … & Ono, T. (2018). The chemokine receptor type 4 antagonist, AMD3100, interrupts experimental tooth movement in rats. Archives of oral biology, 86, 35-39. 全文
|
4.
|
Azechi, T., Kanehira, D., Kobayashi, T., Sudo, R., Nishimura, A., Sato, F., & Wachi, H. (2013). Trichostatin A, an HDAC class I/II inhibitor, promotes Pi-induced vascular calcification via up-regulation of the expression of alkaline phosphatase. Journal of atherosclerosis and thrombosis, 15826.全文
|
5.
|
Abe, F., Takahashi, H., & Tanaka, A. (2019). Investigation on the Action and Effect of Culture Supernatant of Human Dental Pulp Stem Cells Using Rats with Medication-Related Osteonecrosis of the Jaw. Journal of Hard Tissue Biology, 28(4), 349-358.全文
|
6.
|
Kubota, M., Yanagita, M., Mori, K., Hasegawa, S., Yamashita, M., Yamada, S., … & Murakami, S. (2016). The effects of cigarette smoke condensate and nicotine on periodontal tissue in a periodontitis model mouse. PloS one, 11(5), e0155594.全文
|
7.
|
Maruyama, K., Kawagoe, T., Kondo, T., Akira, S., & Takeuchi, O. (2012). TRAF family member-associated NF-κB activator (TANK) is a negative regulator of osteoclastogenesis and bone formation. Journal of Biological Chemistry, 287(34), 29114-29124. 全文
|
8.
|
Liu, S., Kiyoi, T., Takemasa, E., & Maeyama, K. (2015). Systemic Lentivirus-Mediated Delivery of Short Hairpin RNA Targeting Calcium Release–Activated Calcium Channel 3 as Gene Therapy for Collagen-Induced Arthritis. The Journal of Immunology, 194(1), 76-83.全文
|
9.
|
Yamasaki, M., Hasegawa, S., Imai, M., Takahashi, N., & Fukui, T. (2016). High-fat diet-induced obesity stimulates ketone body utilization in osteoclasts of the mouse bone. Biochemical and biophysical research communications, 473(2), 654-661.全文
|
10.
|
Maekawa, S., Katagiri, S., Takeuchi, Y., Komazaki, R., Ohtsu, A., Udagawa, S., & Izumi, Y. (2017). Bone metabolic microarray analysis of ligature‐induced periodontitis in streptozotocin‐induced diabetic mice. Journal of periodontal research, 52(2), 233-245. 全文
|
11.
|
Maruyama, K., Uematsu, S., Kondo, T., Takeuchi, O., Martino, M. M., Kawasaki, T., & Akira, S. (2013). Strawberry notch homologue 2 regulates osteoclast fusion by enhancing the expression of DC-STAMP. Journal of Experimental Medicine, 210(10), 1947-1960. 全文
|
12.
|
Shimomura, S., Inoue, H., Arai, Y., Nakagawa, S., Fujii, Y., Kishida, T., … & Mazda, O. (2018). Treadmill Running Ameliorates Destruction of Articular Cartilage and Subchondral Bone, Not Only Synovitis, in a Rheumatoid Arthritis Rat Model. International journal of molecular sciences, 19(6), 1653.全文
|
13.
|
Yokota, J., Chosa, N., Sawada, S., Okubo, N., Takahashi, N., Hasegawa, T., … & Ishisaki, A. (2014). PDGF-induced PI3K-mediated signaling enhances the TGF‑β‑induced osteogenic differentiation of human mesenchymal stem cells in a TGF-β-activated MEK-dependent manner. International journal of molecular medicine, 33(3), 534-542.全文
|
14.
|
Yeom, K. H., Ariyoshi, W., Okinaga, T., Washio, A., Morotomi, T., Kitamura, C., & Nishihara, T. (2016). Platelet‐rich plasma enhances the differentiation of dental pulp progenitor cells into odontoblasts. International endodontic journal, 49(3), 271-278. 全文
|
15.
|
Saita, M., Kaneko, J., Sato, T., Takahashi, S. S., Wada-Takahashi, S., Kawamata, R., … & Nagasaki, Y. (2016). Novel antioxidative nanotherapeutics in a rat periodontitis model: Reactive oxygen species scavenging by redox injectable gel suppresses alveolar bone resorption. Biomaterials, 76, 292-301.全文
|
16.
|
Wu, Y. H., Taya, Y., Kuraji, R., Ito, H., Soeno, Y., & Numabe, Y. (2019). Dynamic microstructural changes in alveolar bone in ligature‐induced experimental periodontitis. Odontology, 1-11. 全文
|
17.
|
Li, P., Honda, Y., Arima, Y., Yasui, K., Inami, K., Nishiura, A., … & Matsumoto, N. (2016). Interferon-γ enhances the efficacy of autogenous bone grafts by inhibiting postoperative bone resorption in rat calvarial defects. Journal of prosthodontic research, 60(3), 167-176.全文
|
18.
|
Li, P., Hashimoto, Y., Honda, Y., Arima, Y., & Matsumoto, N. (2015). The effect of interferon-γ and zoledronate treatment on alpha-tricalcium phosphate/collagen sponge-mediated bone-tissue engineering. International journal of molecular sciences, 16(10), 25678-25690.全文
|
19.
|
Tezuka, R., & Tanaka, A. (2016). Jawbone Changes in Sodium Zoledronic Acid-and Dexamethasone-Treated Rats. Journal of Hard Tissue Biology, 25(4), 383-394.全文
|
20.
|
Yamada, K., Tsuji, T., & Kunieda, T. (2013). Phenotypic Characterization of Ggt1dwg/dwg Mice, a Mouse Model for Hereditary γ-GlutamylTransferase Deficiency. Experimental animals, 62(2), 151-157. 全文
|
21.
|
Fukushima, H., Shimizu, K., Watahiki, A., Hoshikawa, S., Kosho, T., Oba, D., … & Okabe, K. (2017). NOTCH2 Hajdu-Cheney mutations escape SCFFBW7-dependent proteolysis to promote osteoporosis. Molecular cell, 68(4), 645-658. 全文
|
22.
|
Kawada, S., Wada, E., Matsuda, R., & Ishii, N. (2013). Hyperbaric hyperoxia accelerates fracture healing in mice. PloS one, 8(8), e72603. 全文
|
23.
|
Ikawa, H., Moroi, A., Yoshizawa, K., Saida, Y., Hotta, A., Tsutsui, T., … & Saito, Y. (2017). Bone regeneration enhancement by ultra-violet (UV) treatment for uHA/PLLA absorbable mesh. Journal of Cranio-Maxillofacial Surgery, 45(5), 634-641. 全文
|
24.
|
Sato, M., Asada, N., Kawano, Y., Wakahashi, K., Minagawa, K., Kawano, H., … & Katayama, Y. (2013). Osteocytes regulate primary lymphoid organs and fat metabolism. Cell metabolism, 18(5), 749-758. 全文
|
25.
|
Maruyama, K., Fukasaka, M., Uematsu, S., Takeuchi, O., Kondo, T., Saitoh, T., … & Akira, S. (2015). 5-Azacytidine-induced protein 2 (AZI2) regulates bone mass by fine-tuning osteoclast survival. Journal of Biological Chemistry, 290(15), 9377-9386. 全文
|
26.
|
Okuda, T., Naruo, M., Iijima, O., Igarashi, T., Katsuyama, M., Maruyama, M., … & Haseba, T. (2018). The Contribution of Alcohol Dehydrogenase 3 to the Development of Alcoholic Osteoporosis in Mice. Journal of Nippon Medical School, 85(6), 322-329. 全文
|
27.
|
Gunji, H., Kunimatsu, R., Tsuka, Y., Yoshimi, Y., Sumi, K., Awada, T., … & Yanoshita, M. (2018). Effect of high‐frequency near‐infrared diode laser irradiation on periodontal tissues during experimental tooth movement in rats. Lasers in surgery and medicine, 50(7), 772-780.全文
|
28.
|
Takano, A., Fukuda, T., Shinjo, T., Iwashita, M., Matsuzaki, E., Yamamichi, K., … & Nishimura, F. (2017). Angiopoietin-like protein 2 is a positive regulator of osteoblast differentiation. Metabolism, 69, 157-170.全文
|
29.
|
Tsuchiya, T., Sakai, A., Menuki, K., Mori, T., Takeuchi, Y., Kanoh, S., … & Nakamura, T. (2013). Disruption of aldehyde dehydrogenase 2 gene results in altered cortical bone structure and increased cortical bone mineral density in the femoral diaphysis of mice. Bone, 53(2), 358-368.全文
|
30.
|
Ishikawa, J., Takahashi, N., Matsumoto, T., Yoshioka, Y., Yamamoto, N., Nishikawa, M., … & Yamamoto, A. (2016). Factors secreted from dental pulp stem cells show multifaceted benefits for treating experimental rheumatoid arthritis. Bone, 83, 210-219.全文
|
31.
|
Suzuki, K., Anada, T., Miyazaki, T., Miyatake, N., Honda, Y., Kishimoto, K. N., … & Suzuki, O. (2014). Effect of addition of hyaluronic acids on the osteoconductivity and biodegradability of synthetic octacalcium phosphate. Acta biomaterialia, 10(1), 531-543. 全文
|
32.
|
Tamura, Y., Kawao, N., Yano, M., Okada, K., Okumoto, K., Chiba, Y., … & Kaji, H. (2015). Role of plasminogen activator inhibitor-1 in glucocorticoid-induced diabetes and osteopenia in mice. Diabetes, 64(6), 2194-2206. 全文
|