为解读“生物体内密码”的共培养研究与外泌体
![]()
Ginreilab株式会社 岛崎 猛夫
◆前言
近年,生物学中包含外泌体在内的细胞外囊泡在各种细胞交流中发挥着重要作用,这一点已被阐明,相关论文数量激增。现在外泌体研究的主流,是与各种疾病相关的外泌体的提取和分析方法,并且是如何用于液体活检(Liquid Biopsy)。然而,外泌体作为细胞间相互作用的关键角色,分析真正由外泌体介导的细胞所持机能与疾病的特性,不仅要进行提取、分析外泌体这种类似于身体素质检测的研究,还必须在体内环境中重现生物体内发生的现象,研究其相互作用。
究其原因,是因为至今以外泌体机能分析为目的的基础研究中,通常将癌细胞中提取出的外泌体加入其他细胞中,观察并分析靶细胞行为,然后讨论该外泌体所行驶的功能。以此为基础,分析该外泌体的内含物,使用分子生物学研究方法再对内含物的机能进行分析。这种方法的优点是进行基础的功能分析,就像按下机器开关一样,观察会发生什么现象。
但是,这种研究方法只是按下了开关,然而在实际的生物体内也会发生与投入大量提取外泌体同样的情况吗?换言之,我们也不清楚是否按下了如此强力的开关。另外,由于在生物体内有着“类似的密码机制”(图1),当它与强度、顺序等因素关联较大的情况下,这种研究手法便完全无用。
由于文章篇幅有限,关于生物体内存在“类似的密码机制”的内容不作过多叙述,但我们可以肯定该种现象是真实存在的。提取外泌体,加入其他细胞中的研究可以分析个别外泌体的开关机能,将来这一基本分析方法也不会改变。然而,分析“生物体内密码”,无需提取技术即可观察细胞之间自然相互作用的共培养研究就十分有用。
目前共培养技术已广泛用于实验研究,但外泌体领域使用共培养技术的相对较少。为分析作为外泌体本质的相互作用,活用共培养技术尤为重要。另外,由于有关外泌体的详细说明已有各类参考文献可供查阅,此处不复赘述,因此本文将着重介绍解密生物体内密码的外泌体研究方法的注意点,以及作为解密工具的共培养系统。
图1.生物体内密码概念图
◆关于外泌体研究的注意点
迄今为止,主流研究方法是提取并分析血液等生物体内来源的样本和细胞培养上清液中所含的外泌体,其中还有许多作为液体活检的报告1-5) 。这些研究方法,通过分析外泌体中所含功能性物质,在疾病标记、治疗标靶、治疗应用方面的研究日益盛行。尤其在发现存在于外泌体中的miRNA可在细胞之间传递之后6、7),外泌体内miRNA的分析研究逐渐增多,关于可以筛查疾病的报道也层出不穷。
外泌体研究主要有以下三种方法:①提取外泌体,分析其内容物;②将提取出的外泌体加入其他细胞中确认其反应的研究;③标记外泌体后分析其在细胞中的动态,以及组合①~③的方法进行研究。可以将这些方法按照“是否提取外泌体” 简单划分。
其中重点是,提取、纯化外泌体,添加到其他细胞中、分析摄取后细胞的变化,1)提取方法需要注意外泌体群体的特征;2)大量提取的外泌体引起的现象是否会模拟生物体内现象尚不明确。
1)关于提取方法的影响
当提取外泌体进行分析时,根据提取方式不同,所收集的外泌体可能成为具有偏向性的群体。需要注意的是,各种提取方法除了在收集效率方面各有争议,本身收集的外泌体性质都会受到提取方法影响。
外泌体的提取方法,有使用按照颗粒大小进行分离的超速离心法,或是利用滤膜和微孔结构的过滤法,凝胶排阻差速分离的方法,还有利用表面蛋白或四跨膜蛋白同抗体或亲和性物质结合的分离法等,外泌体的提取方法层出不穷。
提取方法层出不穷的原因在于,我们尚不完全了解外泌体是什么。含有外泌体的细胞外囊泡在早期报导中,认为是由血小板与红细胞分泌的,是细胞的垃圾8、9) 。1983年Johonstone博士将羊的网状红细胞分泌出来的囊泡命名为外泌体10) 。
多种细胞都能分泌外泌体到血液等体液中。外泌体具有许多未知功能,内部含有蛋白质与核酸。它的包膜是脂质双层膜,含有膜蛋白家族的四次跨膜蛋白、膜运输蛋白、整合素等粘附分子。除外泌体以外,细胞分泌的细胞外囊泡中还包含有稍微大于外泌体的质膜由来微囊泡、细胞凋亡后释放的凋亡小体等11) 。
由于研究者对于外泌体的定义并不统一,因此也存在一段混乱的时期。近年,以国际细胞外囊泡学会为中心逐渐统一了外泌体的概念。细胞外囊泡,现在主要划分为3种群体。
(1)直径50 nm – 150 nm含有脂质双层膜的外泌体;(2)100 nm – 1000 nm的细胞中直接分泌出来的小泡,即微囊泡;(3)从凋亡细胞中产生的凋亡小体11) 。
2006年至2007年,提出了外泌体中含有miRNA与RNA,可能通过外泌体在细胞间传递6、7) 。该突破性事件令全世界研究者聚焦细胞外囊泡,各领域中关于外泌体的研究发生了飞跃性进展。
尽管外泌体拥有脂质双层膜,除了在囊泡表面检测出CD9与CD63等四次跨膜蛋白指标外,还未检测出其他绝对的指标。因此,利用超离法根据颗粒大小分离的囊泡,或者市售的各种提取试剂盒分离的囊泡,大多数研究都是通过检测颗粒大小和四次跨膜蛋白作为“外泌体提取”成功的标志。
根据我们的分析,外泌体表面的四次跨膜蛋白数量并不是恒定的,根据细胞种类和细胞状态,是否表达、表达量都会有巨大的差异,而且使用试剂不同,表达也会发生改变。因此,在使用针对四次跨膜蛋白的抗体反应的试剂盒(例如CD9或CD81)进行定量时,我们建议您牢记这一点进行分析。
总之,请注意不要“只看到自己想看见的东西”。我们为了分离不是表达特定标记的外泌体,使用了超离法或脂质亲和的简易试剂盒(MagCapture™ 外泌体提取试剂盒PS)进行分析。
2)外泌体给药实验注意点
我们使用荧光探针标记后进行所提取外泌体的成像分析12、13) 以及使用氧化铁纳米粒子探针标记14、15),对其他细胞或动物进行给药分析。但是,需要注意的是,大量加入所提取到的外泌体可能会导致与原来生理性机能相左的结果出现。
由于外泌体给药过多也会出现与预期相反的反应途径,因此确认浓度十分重要。然而,在至今进行的众多给药实验中类似于“按下开关会发生什么?”的分析研究,是一种既定的外泌体研究方法16-21) 。
◆为解读“生物体内密码”的共培养研究
现在存在一种可以克服上述问题的外泌体研究方法。即不提取外泌体,让细胞分泌物与细胞进行间接性相互作用的共培养研究。细胞共培养能够观察到各个细胞自然的相互作用,而细胞之间自然的相互作用,正是在细胞之间按下“生物体内密码”的研究,更有可能观察到不同于简单按下开关时的现象。总而言之,解读“生物体内密码”,建议采用研究细胞间相互作用的共培养研究方法。
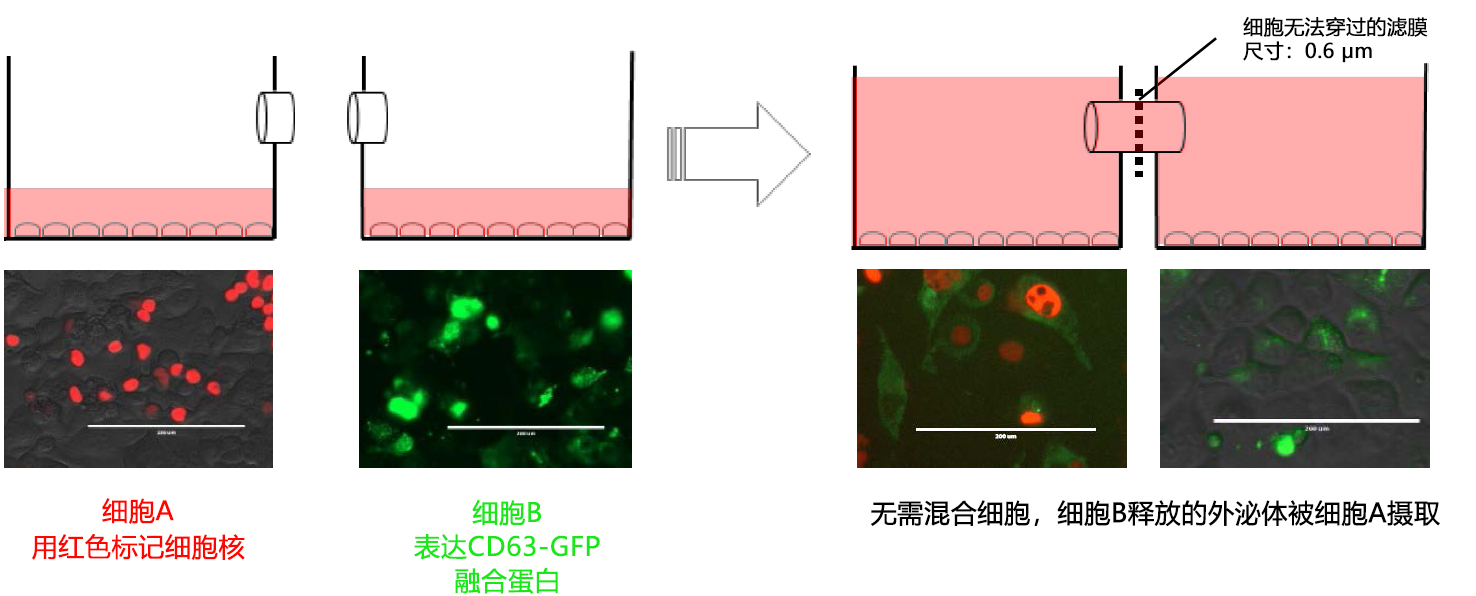
共培养研究作为细胞间交流的研究方式在1980年代逐渐推广,后来在各领域中被使用。使用共培养系统进行研究的主要动机,就是研究细胞与微生物之间的相互作用22) ,并且利用这种相互作用开发新的细胞工程技术23、24) 。关于外泌体的共培养研究,主要采取荧光标记外泌体表面上的CD63、CD81、CD9等标记物,以此研究外泌体在细胞内的动态以及细胞摄取的方法。
这些研究方式的优点就是能观察到外泌体介导的自然作用。但是,CD63等表面标记物的发现,根据细胞种类与状态的不同,也存在着一部分没有表面标记物的细胞。另外,关于使用荧光标记的研究,也存在着标记分子的识别准确性等光学特性方面的问题。即使如此,这些方法仍然是研究生物体内细胞间相互作用的不可或缺的研究方式。
使用共培养系统所进行的外泌体研究不断增加,举个例子,有将外泌体表面局部存在的CD63和GFP蛋白融合,尝试对外泌体行为进行可视化的报告11);让乳癌细胞摄入间充质干细胞(MSC)来源外泌体,来评估MSC细胞能力的报告25) ;阐明在共培养中MSC来源CD90表达的报告25) ;在使用荧光标记的实验中,确认外泌体发生了交换、移动的报告25-27) 。
迄今为止,使用上下型共培养容器的实验,是在不混合细胞的情况下进行培养的一种重要模型,这种模型有外泌体以及外泌体中的miR-320参与糖尿病模型大鼠心肌细胞与小鼠心肌细胞在共培养中抑制血管增生的报告27) ,与证明病毒来源的miRNAs通过外泌体介导转入到其他细胞的报告28) 。另外,还有报告指出使用Transwell® co-culture plate在细胞隔膜上下进行细胞培养,在不直接接触细胞的条件下,外泌体能够介导细胞性质的变化29、30) 。在体内血脑屏障(BBB)模型中,也有使用Transwell® co-culture plate见诸报导13) :将脑血管内皮细胞、周细胞、星形胶质细胞这三种细胞作为共培养模型,模拟BBB。这些实验都很好地利用了co-culture plate。
◆关于共培养研究方法
现有的共培养系统通常根据细胞贴壁状态,分为接触型直接共培养与非接触型间接共培养两大类。混合细胞的方法就是直接共培养,让细胞直接接触。虽然一般使用的都是直接共培养,但是该方法难以逐个分析细胞,只能用于分析细胞团。除了接触直接产生作用外,还有必要注意实际加入的液体因子所带来的影响。因此,该方法虽然方便,但是难以分析结果。
另一方面,间接共培养是将细胞置于分离的环境中,通过液体因子介导细胞之间的相互作用。使用培养容器、滤膜、凝胶等将细胞置于非直接物理接触的状态下再观察细胞之间的作用,可以间接明确液体因子的作用。
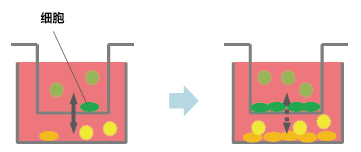
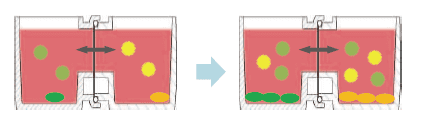
间接共培养技术,主要分为三种方法31) (图2)。①滤膜分隔型;②利用凝胶等半固态物分隔细胞,通过凝胶交换因子系统型;③不完全分隔,利用高低差或水滴等培养细胞群体,不使用分隔物质的方法。
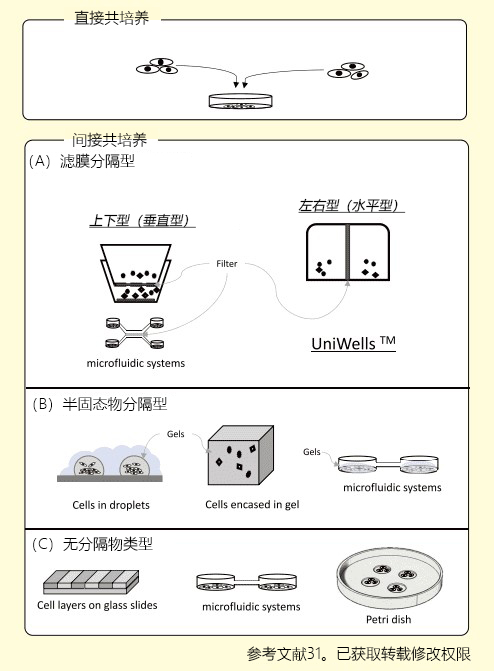
图2.共培养方法概略图
除此以外,交换培养液的方法还应用于细菌等研究32) 。通过滤膜将上下连接容器分隔的共培养容器Boyden chamber33-35)或改自Boyden chamber的Transwell® co-culture plate作为标准。
Boyden chamber于1962年由Stephan Boyden发明,是一种将培养容器上下连接,在上方培养容器的底部安装滤膜,通过使用滤膜进行共培养的方式。除Transwell® co-culture plate以外,一般被称为Cell culture insert。
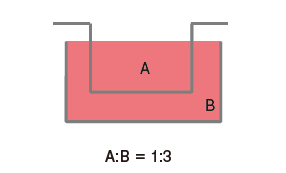
Cell culture insert早期被用于细胞侵袭实验的评估,迄今已作为众多间接共培养方法的标准使用。但是上方培养容器中的细胞因与显微镜焦点距离的问题,导致难以获得清晰的图像,另外还存在上方细胞培养容器底部的材质与下方细胞培养容器的材质不一致的缺点。细胞行为大多数会受到底部材质的影响,底部材质差异造成的影响不可忽视。另外,由于需要将滤膜用作一体化容器,可供选择的滤膜种类也受到限制。
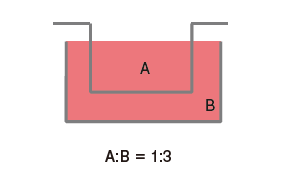
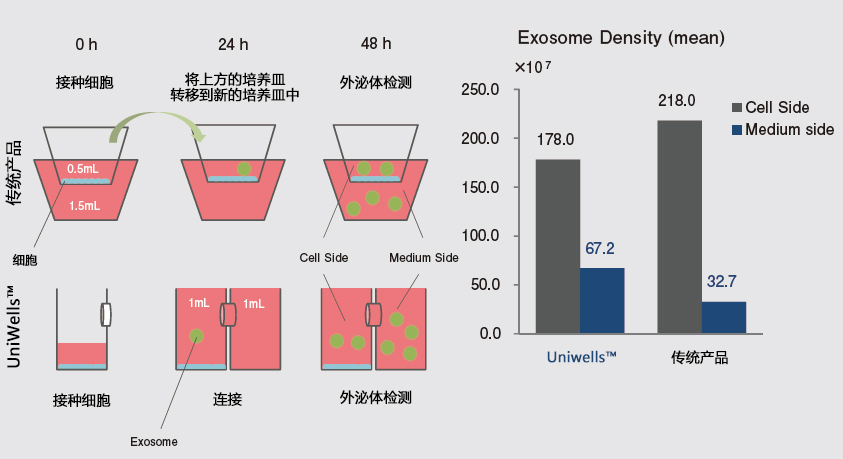
再者,关于共培养效率方面,上下型共培养容器因其构造特性,无论如何都会变成套桶结构。因此,容器的容积比为1:3,差异过大会导致细胞分泌的液体因子被稀释。而且由于上方容器中的细胞位于滤膜上部,细胞密度增高会导致滤膜的滤孔堵塞,共培养效果随时间增加而下降。
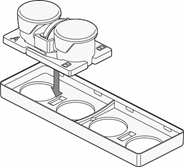
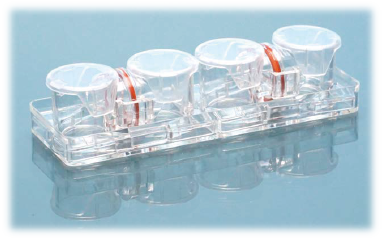
出乎意料的是,尚未发现横向连接的滤膜分隔型容器。最近,出现了为实现细菌研究的横向容器报告32),但并不是以观察为目的。因此我们开发了可在显微镜下观察的新型横向连接型细胞培养容器——水平共培养容器。(UniWells™:由富士胶片和光纯药株式会社销售)。
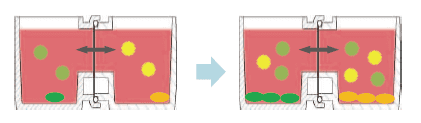
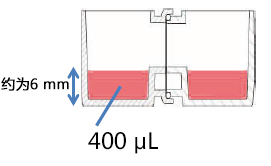
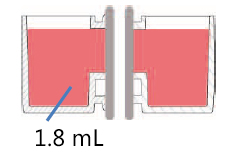
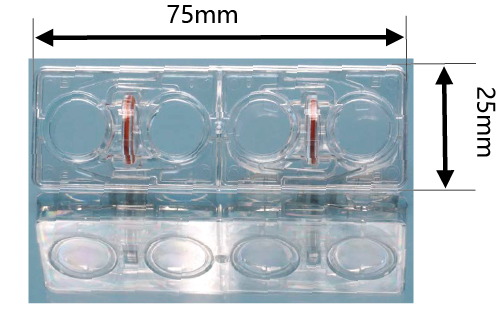
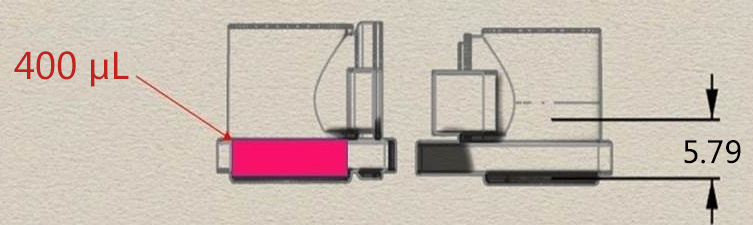
本文介绍的我们开发的此款共培养容器31),是一款可在容器之间置入任意商品化滤膜的培养容器,各个容器既可单独进行培养,亦可将两个容器进行组装培养。可分别在不同环境进行培养后再进行共培养,通过培养液量控制共培养状态(图3)。
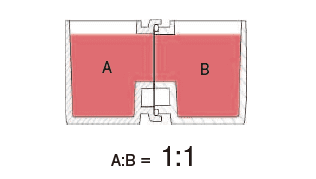
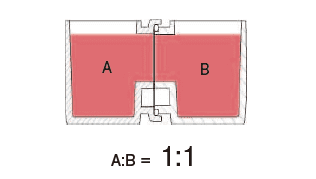
这种水平式共培养容器的最大优点就是由于细胞与滤膜分离,并不会出现上述细胞密度过高导致液体因子移动性降低的缺点。另外由于容器的容积比为1:1,能够令共培养效果最大化,且可在两个容器中进行同步观察。
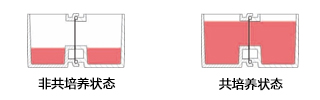
有两种使用方法,一是在单体培养后,连接(结合)两个容器进行共培养。二是从一开始便将两个容器相连,利用连接面的高低差,控制共培养状态。
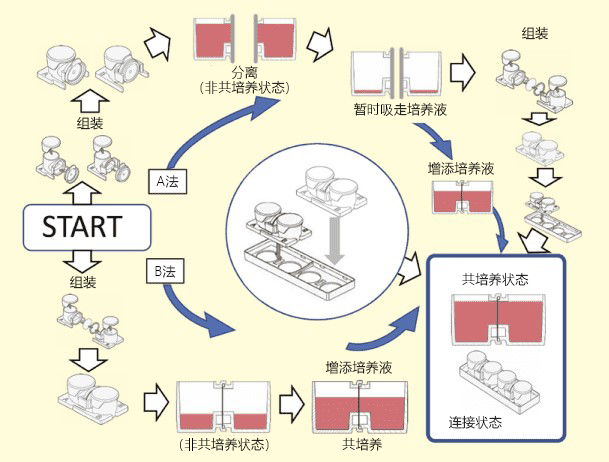
图3. 共培养容器的使用方法
方法A:单独培养后组装连接为共培养系统
方法B:开始便将培养容器组装,通过控制培养液量进行共培养
组装简单,可供研究者在两种方法中任意选择。如需使用凝胶等进行3D培养,亦可进行细胞3D培养的共培养。插入型细胞培养容器,由于是上下连接,不可在显微镜下同时观察两边细胞,但是我们开发的共培养容器,由于是水平连接,则可同时观察两边的细胞。
无论使用哪种系统,Co-culture systems都适用于细胞间相互作用的观察研究以及利用细胞相互作用的细胞工程技术。我们认为,共培养系统为细胞工程的各种研究方法提供可能性,对于药物研发的作用也不可忽视24) 。
◆关于外泌体研究的展望
外泌体研究在肿瘤、免疫疾病、神经疾病、再生医学领域中,其与一些未知疾病的原因和机理已逐渐得到阐明。我们觉得仍然存在外泌体的提取方式尚未标准化的问题,但外泌体与疾病相关的研究将会阐明疾病与外泌体内含物之间的关系。
然而,关于外泌体相关的生理学机能,分泌、摄取的基础机制的知识仍然不够充分,特别是考虑到生物体内恰恰存在着如同密码一样的相互作用系统,为达成创新性的研究,利用共培养系统的外泌体研究尤为重要。
随着利用共培养系统的先驱性研究增多,我们期待有朝一日能够阐明外泌体介导的“生物体内密码”。
◆参考文献
1)Taylor, D. D. and Gercel-Taylor, C. : Gynecol. Oncol., 110, 13 (2008).
2)Murakami, Y. et al. : PLoS One, 7, e48366 (2012).
3)Moon, P. G. et al. : Proteomics, 11, 2459 (2011).
4)Hoshino, A. et al. : Nature, 527, 329 (2015).
5)Kosaka, N. et al. : J. Clin. Invest., 126, 1163 (2016).
6)Valadi, H. et al. : Nat. Cell Biol., 9, 654 (2007).
7)Ratajczak, J. et al. : Leukemia, 20, 847 (2006).
8)Chargaff, E. and West, R. : J. Biol. Chem., 166, 189 (1946).
9)Wolf, P. : Br. J. Haematol., 13, 269 (1967).
10)Johnstone, R. M. et al. : J. Biol. Chem., 262, 9412 (1987).
11)Yanez-Mo, M. : J. Extracell. Vesicles, 4, 27066 (2015).
12)Smyth, T. et al. : J. Control. Release, 199, 145 (2015).
13)Wiklander, O. P. et al. : J. Extracell. Vesicles, 4, 26316 (2015).
14)Busato, A. et al. : Int. J. Nanomedicine, 11, 2481 (2016).
15)Hu, L. et al. : Magn. Reson. Med., 74 (1), 266 (2014).
16)Chen, Y. et al. : Oncogene, 36, 4692 (2017).
17)Yuyama, K. et al. : J. Neurochem., 105, 217 (2008).
18)Rappa, G. et al. : Mol. Cancer, 12, 62 (2013).
19)Chowdhury, R. et al. : Oncotarget, 6, 715 (2015).
20)Saeed-Zidane, M. et al. : PLoS One, 12, e0187569 (2017).
21)Ekstrom, K. et al. : J. Extracell. Vesicles, 1 (2012). doi: 10.3402/jev.v1i0.18389
22)Cottet, S. et al. : J. Biol. Chem., 277, 33978 (2002).
23)Tanouchi, Y. et al. : Curr. Opin. Biotechnol., 23, 791 (2012).
24)Moraes, C. et al. : Ann. Biomed. Eng., 40, 1211 (2012).
25)Yang, Y. et al. : Int. J. Oncol., 47, 244 (2015).
26)Hergenreider, E. et al. : Nat. Cell Biol., 14, 249 (2012).
27)Wang, X. et al. : J. Mol. Cell. Cardiol., 74, 139 (2014).
28)Shin, Y. et al. : Nat. Protoc., 7, 1247 (2012).
29)Su, M. J. et al. : Sci. Rep., 6, 30110 (2016).
30)Li, Y. et al. : Stem Cell Res, Ther., 8, 198 (2017).
31)Shimasaki, T. et al. : Biol. Pharm. Bull., 41, 1311 (2018).
32)Moutinho, T. J., Jr. et al. : PLoS One, 12, e0182163 (2017).
33)Boyden, S. : J. Exp. Med., 115, 453 (1962).
34)Thomsen, R. and Lade Nielsen, A. : Glia, 59, 1782 (2011).
35)Albini, A. et al. : Cancer Res., 47, 3239 (1987).
点击此处查看Uniwells水平共培养容器详细介绍